Характерните свойства на материята (физични и химични)
на характерни свойства на материята те са химически или физически свойства, които могат да помогнат за идентифициране или разграничаване на едно вещество от друго. Физическите свойства са характеристики на вещество, което се наблюдава със сетивата. Химичните свойства са характеристики, които описват как веществото се променя от едно вещество в друго по време на химическа реакция.
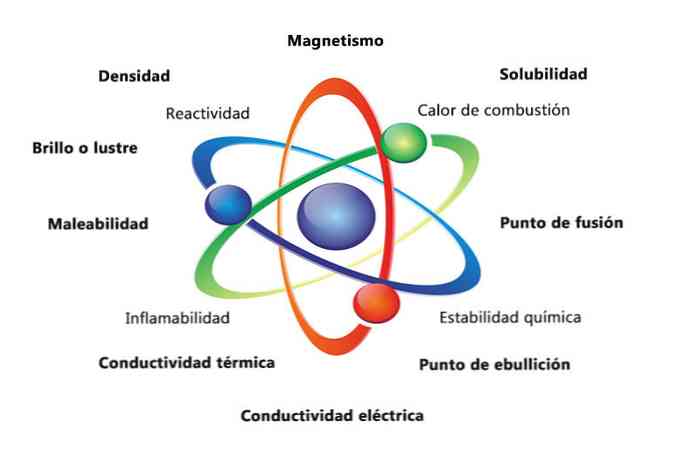
Някои физични свойства на веществото са плътност, разтворимост, точка на топене, цвят и маса. Химичните свойства на материала включват запалимост, реактивност с киселини и корозия. Някои примери за това как свойствата на материята могат да помогнат да се идентифицира елемент е да се сравни плътността на различните елементи.
Елемент като златото има плътност от 19,3 грама на кубичен сантиметър, докато плътността на сярата е 1,96 грама на кубичен сантиметър. По същия начин точките на топене на вещества като вода и изопропилов алкохол са различни.
Физични свойства на материята
Физическите свойства на материята са свойства, които могат да бъдат измерени или наблюдавани, без да се променя химическата природа на веществото. Някои примери за физически свойства са:
- Плътност: количеството вещество, което има обект, се изчислява чрез разделяне на масата по обем.
- Магнетизъм: силата на привличане между магнит и магнитен обект.
- Разтворимост: мярка за това колко добре веществото може да се разтвори в друго вещество.
- Точка на топене: температура, при която вещество се променя от твърдо към течно.
- Точка на кипене: температура, при която вещество се променя от течност към газ.
- Електрическа проводимост: е мярка за това колко добре се движат електрическите токове през вещество.
- Топлинна проводимост: скоростта, с която веществото пренася топлината.
- Пригодност: е способността на веществото да се разточва или смила по различни начини.
- Блясък или блясък: колко лесно отразява обекта светлината.
Химични свойства на материята
Химичните свойства описват способността на веществото да се трансформира в ново вещество с различни свойства. По-долу са дадени няколко примера за химични свойства:
- Топлина на горене: енергията, която се освобождава, когато съединението претърпи пълно изгаряне с кислород.
- Химична стабилност: отнася се до това дали съединението ще реагира с вода или въздух (химически стабилни вещества няма да реагират).
- Запалимост: способността на съединението да гори при експозиция на пламък.
- Реактивност: способност за взаимодействие с друго вещество и образуване на едно или повече нови вещества.
Физически състояния на материята
Материята е нещо, което заема пространство, което има маса и което може да бъде възприето от нашите сетива. Материята може да се класифицира според неговото физическо състояние: твърдо, течно и газообразно.
1 - Твърди вещества и техните характерни свойства
Всички твърди вещества имат маса, заемат пространство, имат определен обем и форма, не се плъзгат през пространството и не могат да бъдат компресирани или да имат твърда форма. Като примери имаме: дърво, книги, гъби, метал, камъни и др..
В твърдите вещества малките частици на материята са много близки и се допират. Частиците са толкова близо един до друг, че не могат да се движат много, има много малко пространство между тях.
2 - Течности и техните характерни свойства
Всички течности имат маса, заемат пространство, имат определен обем, но нямат определена форма (тъй като те се адаптират към контейнера, където са), те могат да бъдат компресирани в много малка степен и могат да се плъзгат през пространството. Като примери имаме: вода, керосин, масло и др..
В течностите малките частици на материята са малко по-далеч една от друга, между тях има повече пространство (в сравнение с твърдите вещества) и те не се допират. Следователно, частиците могат да се движат между пространствата, да бутат и да се сблъскват с други частици, постоянно да променят посоката си.
3 - Газовете и техните характерни свойства
Всички газове имат маса, заемат пространство, нямат определен обем или форма, могат да бъдат компресирани до голяма степен и могат да се разпространяват в пространството. Като примери имаме: водород, кислород, азот, въглероден диоксид, пара и др..
В газовете малките частици на материята са далеч по-далеч, между тях има много повече пространство (в сравнение с течностите) и те не се допират. Частиците имат максимална свобода на движение, така че те бутат и се сблъскват с други частици, които непрекъснато променят посоката си.
Промени в състоянието на материята
Материята може да се преобразува от твърдо състояние в течно състояние и обратно, и от течно състояние в газообразно състояние и обратно. Това преобразуване носи името на промяната на състоянието и се случва чрез промени в температурата:
сливане
Промяна на състоянието на материала от твърдо към течно чрез повишаване на температурата. Когато се нагрява твърдо вещество, топлината кара частиците да вибрират по-енергично.
При достигане на точката на топене, твърдите частици имат достатъчна кинетична енергия за преодоляване на енергийните сили на привличане, които ги задържат в неподвижни позиции, и те се счупват, за да образуват малки групи от течни частици..
Кипене или изпаряване
Промяна на състоянието на течната материя в газообразна чрез повишаване на температурата. Когато се нагрява течно вещество, топлината кара частиците да се движат още по-бързо.
При достигане на точката на кипене, течните частици имат достатъчна кинетична енергия, за да преодолеят силите на привличане, които ги задържат в неподвижни позиции и се разделят на отделни газообразни частици..
Замразяване или втвърдяване
Промяна на състоянието на течната материя до твърдо чрез понижаване на температурата. Когато едно течно вещество се охлажда, частиците му губят много кинетична енергия. Когато достигнат точката на замръзване, частиците спират да се движат и вибрират във фиксирана позиция, превръщайки се в твърди частици.
Втечняване или кондензация
Промяна на състоянието на газообразния материал в течност чрез намаляване на температурата. Когато едно газообразно вещество се охлажда, неговите частици губят много кинетична енергия, което ги кара да се привличат помежду си като течни частици.
сублимация
Някои материали се променят директно от твърдото си състояние в тяхното газообразно състояние или обратно, без да преминават през течното състояние. Когато тези твърди вещества се загряват, техните частици се движат толкова бързо, че отделят напълно образуващата се пара или газ, и обратно, когато процесът се случва от газообразно към твърдо вещество.
препратки
- De Podesta, М. Разбиране на свойствата на материята, 2-ро издание. Великобритания: Тейлър и Франсис.
- Гоел А. Състояния на материята. Ню Делхи: Издателска къща "Дискавъри".
- Moore J, Stanitski C. Молекулярната наука, пето издание. Стамфорд: Cengage Learning.
- Рамакришна А. Природа на материята, 1-во издание. Ню Делхи: Братя Гоял Пракашан.
- Регер Д, Гуд S, Бал Д. Химия. Принципи и практика, 3-то издание. Канада: Brooks / Cole, Cengage Learning.
- Shapere D. Matter (физика). Възстановен от: accessscience.com.
- Сингх Л, Каур М. Материя в нашата околност. Индия: Училище S. Chand.


