История на калориметъра, части, видове и техните характеристики
на калориметър е устройство, което се използва за измерване на промяната в температурата на дадено количество вещество (обикновено вода) с известна специфична топлина. Тази промяна в температурата се дължи на топлината, която се абсорбира или освобождава в процеса на изследване; химически, ако е реакция, или физически, ако се състои от фаза или промяна на състоянието.
В лабораторията най-простият калориметър, който може да се намери, е този на чашата за кафе. Използва се за измерване на топлината, абсорбирана или отделена при реакция при постоянно налягане във воден разтвор. Реакциите се избират, за да се избегне намесата на реагенти или газообразни продукти.
 При екзотермична реакция количеството на отделената топлина може да се изчисли от повишаването на температурата на калориметъра и водния разтвор:
При екзотермична реакция количеството на отделената топлина може да се изчисли от повишаването на температурата на калориметъра и водния разтвор:
Количеството топлина, което се отделя в реакцията = количеството топлина, абсорбирана от калориметъра + количеството топлина, абсорбирана от разтвора
Количеството топлина, абсорбирано от калориметъра, се нарича калориметричен капацитет на калориметъра. Това се определя чрез подаване на известно количество топлина към калориметъра с определена маса вода. След това се измерва повишаването на температурата на калориметъра и съдържащия се разтвор.
С тези данни и използването на специфичната топлина на водата (4.18 J / g) може да се изчисли калоричният капацитет на калориметъра. Този капацитет също се нарича калориметрична константа.
От друга страна, топлината, получена от водния разтвор, е равна на m · ce · Δt. Във формулата m = масата на водата, ce = специфичната температура на водата и Δt = изменението на температурата. Знаейки всичко това, тогава може да се изчисли количеството топлина, отделено от екзотермичната реакция.
индекс
- 1 История на калориметъра
- 2 Части
- 3 Видове и техните характеристики
- 3.1 Чаша за кафе
- 3.2 Калориметрична помпа
- 3.3 Адиабатен калориметър
- 3.4 Изопериболичен калориметър
- 3.5 Поточен калориметър
- 3.6 Калориметър за диференциална сканираща калориметрия
- 4 Приложения
- 4.1 Във физикохимията
- 4.2 В биологичните системи
- 4.3 Калориметър на кислородната помпа и калорична мощност
- 5 Препратки
История на калориметъра
През 1780 г., А. Л. Лавуазие, френски химик, считан за един от бащите на химията, използвал морско свинче, за да измери производството на топлина чрез дишането си..
Как? Използване на устройство, подобно на калориметър. Топлината, произведена от морското свинче, е доказана от топенето на снега, който заобикаля апарата.
Изследователи А. Л. Лавуазие (1743-1794) и П. С. Лаплас (1749-1827) проектираха калориметър, използван за измерване на специфичната топлина на тялото чрез метода на топене на леда..
Калориметърът се състои от цилиндрична чаша, покрита с калай, лакирана, държана от статив и вътрешно завършваща с фуния. Вътре е поставена друга чаша, подобна на предишната, с тръба, която минава през външната камера и е снабдена с ключ. Във второто стъкло имаше мрежа.
В тази решетка е поставено съществото или обект, чиято специфична топлина е желана да се определи. Лед беше поставен вътре в концентричните съдове, точно както в кошницата.
Произведената от тялото топлина се абсорбира от леда, което води до неговото сливане. И течният воден продукт на топенето на леда беше събран, отваряйки ключа на вътрешното стъкло.
И накрая, претегляйки водата, масата на разтопения лед беше известна.
части
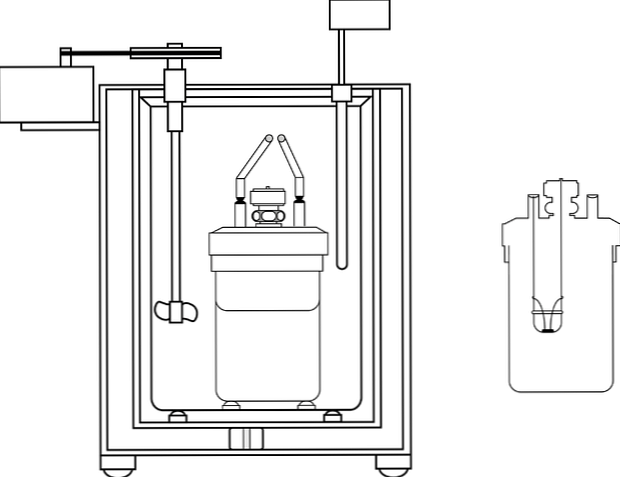
Най-често използваният калориметър в учебните лаборатории по химия е така нареченият калориметър за чашки за кафе. Този калориметър се състои от чаша или вместо това от контейнер с анимен материал, който има определени изолационни свойства. Вътре в този контейнер водният разтвор се поставя в тялото, което ще произвежда или абсорбира топлината.
В горната част на контейнера е поставен капак от изолационен материал с два отвора. В един термометър се въвежда за измерване на температурните промени, а в другия се използва бъркалка, за предпочитане от стъклен материал, който изпълнява функцията на преместване на съдържанието на водния разтвор..
Изображението показва частите на калориметрична помпа; Въпреки това, може да се види, че той има термометър и бъркалка, общи елементи в няколко калориметри.
Видове и техните характеристики
Чашата за кафе
Той е такъв, който се използва за определяне на топлината, отделена при екзотермична реакция, и топлината, абсорбирана в ендотермична реакция..
Освен това може да се използва за определяне на специфичната топлина на тялото; това е количеството топлина, което един грам от веществото трябва да абсорбира, за да повиши температурата му с един градус по Целзий. .
Калориметричната помпа
Това е устройство, в което се измерва количеството топлина, което се освобождава или абсорбира в реакция, която се осъществява при постоянен обем.
Реакцията протича в силен стоманен съд (помпата), който се потапя в голям обем вода. Това прави малките промени в температурата на водата. Следователно се приема, че промените, свързани с реакцията, се измерват при постоянна температура и обем.
Горното показва, че не се извършва работа, когато реакцията се провежда в калориметрична помпа.
Реакцията започва с подаване на електричество чрез кабели, свързани към помпата.
Адиабатичният калориметър
Характеризира се с изолираща структура, наречена щит. Щитът е разположен около клетката, където се получават топлинни и температурни промени. Той е свързан и с електронна система, която поддържа температурата си много близка до тази на клетката, за да се избегне пренос на топлина.
В адиабатен калориметър, температурната разлика между калориметъра и околностите му е сведена до минимум; както и минимизиране на коефициента на топлопреминаване и времето за топлообмен.
Неговите части се състоят от следното:
-Клетката (или контейнерът), интегрирана в изолационна система, чрез която се опитва да избегне загубата на топлина.
-Термометърът за измерване на температурните промени.
-Нагревател, свързан с управляем източник на електрическо напрежение.
-И щитът, вече споменат.
В този тип калориметър могат да се определят свойства като ентропия, температура на Дебая и плътност на електронното състояние.
Изопериболичният калориметър
Това е устройство, в което реакционната клетка и помпата са потопени в структура, наречена сако. В този случай така нареченото яке се състои от вода, поддържана при постоянна температура.
Температурата на клетката и помпата се повишават при отделянето на топлината по време на процеса на горене; но температурата на водната риза се поддържа при фиксирана температура.
Микропроцесорът контролира температурата на клетката и кожуха, като прави необходимите корекции на изтичащата топлина, която е резултат от разликите между двете температури..
Тези корекции се прилагат непрекъснато и с окончателна корекция въз основа на измерванията преди и след изпитването.
Поточен калориметър
Разработено от Caliendar, то има устройство за преместване на газ в контейнер с постоянна скорост. При добавяне на топлина се измерва повишаването на температурата в течността.
Поточният калориметър се характеризира с:
- Точно измерване на постоянния дебит.
- Точно измерване на количеството топлина, внесено във флуида през нагревател.
- Точно измерване на повишаването на температурата в газа, причинено от вложената енергия
- Проект за измерване на капацитета на газ под налягане.
Калориметър за диференциална сканираща калориметрия
Характеризира се с наличието на два контейнера: в едната пробата се поставя, а другата се държи празна или се използва референтен материал..
Двата съда се нагряват с постоянна енергийна скорост посредством два независими нагревателя. Когато започне нагряването на двата контейнера, компютърът ще начертае разликата на топлинния поток на нагревателите спрямо температурата, като по този начин ще може да определи потока на топлина..
Освен това може да се определи изменението на температурата като функция на времето; и накрая, калоричният капацитет.
приложения
Във физикохимията
-Основните калориметри, тип чашка за кафе, позволяват да се измери количеството топлина, което тялото отделя или абсорбира. Те могат да определят дали реакцията е екзотермична или ендотермична. Освен това може да се определи специфичната топлина на тялото.
-С адиабатичния калориметър е възможно да се определи ентропията на химичния процес и електронната плътност на състоянието.
В биологичните системи
-Микрокалориметрите се използват за изследване на биологични системи, които включват взаимодействия между молекулите, както и молекулярните конформационни промени, които се случват; например, при разгъването на молекулата. Линията включва диференциално сканиране и изотермично титруване.
-Микрокалориметърът се използва при разработването на лекарства от малки молекули, биотерапевтици и ваксини.
Калориметър и калоричност на кислородната помпа
Изгарянето на множество вещества се извършва в калориметъра на кислородната помпа и може да се определи неговата калорична мощност. Сред изследваните вещества чрез използването на този калориметър са: въглища и кокс; хранителни масла, тежки и леки; бензин и всички моторни горива.
Както и видовете горива за реактори на въздухоплавателни средства; отпадъци от горива и изхвърляне на отпадъци; хранителни продукти и добавки за човешко хранене; фуражни култури и добавки за храна на животни; строителни материали; ракети и горива.
По същия начин калоричната мощност се определя чрез калориметрия в термодинамични изследвания на горими материали; в изследването на енергийния баланс в екологията; в експлозиви и термични прахове и в преподаването на основни термодинамични методи.
препратки
- Уитън, Дейвис, Пек и Стенли. Химия. (8-мо изд.). CENGAGE Обучение.
- González J., Cortés L. & Sánchez A. (s.f.). Адиабатна калориметрия и нейните приложения. Възстановен от: cenam.mx
- Wikipedia. (2018). Калориметър. Изтеглено от: en.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (22 юни 2018 г.). Определяне на калориметър в химията. Изтеглено от: thoughtco.com
- Гилеспи, Клеър. (11 април 2018 г.). Как действа калориметърът? Sciencing. Изтеглено от: sciencing.com


