Химическа активационна енергия, от която се състои, изчисление
на енергия за химическо активиране (от гледна точка на кинетичните изследвания) се отнася до най-малкото възможно количество енергия, необходимо за започване на химическа реакция. Според теорията на сблъсъците в химическата кинетика се казва, че всички молекули, които са в движение, имат определено количество кинетична енергия..
Това означава, че колкото по-голяма е скоростта на вашето движение, толкова по-голяма е кинетичната енергия. В този смисъл молекула, която носи бързо движение, не може да бъде разделена на фрагменти сама по себе си, така че трябва да се получи сблъсък между нея и друга молекула, така че да може да се получи химическа реакция..
Когато това се случи - когато се случи сблъсък между молекулите - част от нейната кинетична енергия се трансформира в вибрационна енергия. По същия начин, ако в началото на процеса кинетичната енергия е висока, молекулите, които участват в сблъсъка, ще създадат толкова голяма вибрация, че някои от присъстващите химически връзки ще бъдат разбити..
Това разкъсване на връзките е първата стъпка в превръщането на реагентите в продукти; тоест при формирането им. От друга страна, ако в началото на този процес кинетичната енергия е с малка величина, ще има феномен на "отскок" на молекулите, чрез който те ще се разделят практически непокътнати..
индекс
- 1 От какво се състои??
- 1.1 Активиран комплекс
- 2 Как се изчислява?
- 2.1 Изчисляване на енергията на активиране на химическа реакция
- 3 Как енергията на активиране влияе на скоростта на реакцията?
- 4 Примери за изчисляване на енергията на активиране
- 5 Препратки
От какво се състои??
Като се започне от концепцията за сблъсъци между молекули, за да се инициират химичните реакции, описани по-горе, може да се каже, че има минимално количество енергия, необходимо за възникване на сблъсък..
Така че, ако енергийната стойност е по-малка от този необходим минимум, просто няма да има промяна между молекулите след настъпването на сблъсъка, което означава, че когато тази енергия липсва, засегнатите видове остават практически непокътнати и няма да се случат. всяка промяна поради този шок.
В този ред на идеите, минималната енергия, която е необходима, за да настъпи промяна след сблъсък между молекули, се нарича енергия на активиране.
С други думи, молекулите, участващи в шок, трябва да имат сума на обща кинетична енергия с величина, равна на или по-голяма от енергията на активиране, така че да може да настъпи химическа реакция.
Също така, в много случаи молекулите се сблъскват и създават нов вид, наречен активиран комплекс, структура, която също се нарича "преходно състояние", защото съществува само временно..
Тя се причинява от видовете реагенти, дължащи се на сблъсък и преди образуването на продуктите от реакцията.
Активиран комплекс
Активираният комплекс, споменат по-горе, образува вид, който има много ниска стабилност, но който от своя страна има голямо количество потенциална енергия.
Следващата диаграма показва преобразуването на реагентите в продукти, изразени като енергия и отбелязва, че величината на енергията на образувания активиран комплекс е значително по-голяма от тази на реагентите и продуктите..
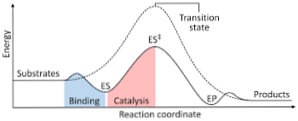
Ако в края на реакцията продуктите имат по-голяма стабилност от реагентните вещества, отделянето на енергия се осъществява под формата на топлина, което дава екзотермична реакция..
Напротив, ако реагентите водят до стабилност с по-голяма величина от продуктите, това означава, че реакционната смес проявява абсорбция на енергия под формата на топлина от околната среда, което води до ендотермична реакция..
По същия начин, ако се случи един случай или друго, трябва да се изгради диаграма, като показаната по-горе, където се начертава потенциалната енергия на системата, която реагира срещу напредъка или напредъка на реакцията..
По този начин се получават потенциалните енергийни промени, които се случват с протичането на реакцията и реагентите се трансформират в продукти.
Как се изчислява?
Енергията на активиране на химичната реакция е тясно свързана с константата на скоростта на тази реакция и зависимостта на тази константа от температурата е представена от уравнението на Аррениус:
k = Ae-Ea / RT
В този израз к представлява константата на скоростта на реакцията (която зависи от температурата) и параметъра А това се нарича честотен фактор и това е мярка за честотата на междумолекулните сблъсъци.
От своя страна, и изразява основата на поредицата от естествени логаритми. Тя се повишава до мощност, равна на отрицателното коефициент на енергията за активиране (Ea) между продукта, получен от газовата константа (R) и абсолютната температура (T) на системата за разглеждане.
Трябва да се отбележи, че честотният фактор може да се разглежда като константа в някои реакционни системи в широк температурен диапазон.
Този математически израз първоначално се предполагаше от химика от нидерландския произход Якобус Генрик вант Хоф през 1884 г., но който му даде научна валидност и интерпретира предпоставката му за родения в Швеция химик Svante Arrhenius, през 1889 г..
Изчисляване на енергията на активиране на химична реакция
Уравнението на Arrhenius показва директната пропорционалност, която съществува между константата на скоростта на реакцията и честотата на сблъсъците между молекулите..
Също така, това уравнение може да бъде представено по по-удобен начин чрез прилагане на свойството на естествените логаритми към всяка страна на уравнението, получавайки:
ln k = ln A - Ea / RT
При преподреждане на термините, за да се получи уравнението на ред (y = mx + b), се постига следният израз:
ln k = (- Ea / R) (1 / T) + ln A
Така че при конструирането на графика на ln k срещу 1 / T получаваме права линия, където ln k представлява y координатата, (- A / R) представлява наклона на линията (m), (1 / T) представлява координатата x, а ln A представлява пресечната точка с оста на ординатата (b).
Както може да се види, наклонът, получен от това изчисление, е равен на стойността на -Ea / R. Това означава, че ако се желае да се получи стойността на енергията на активиране чрез този израз, трябва да се извърши просто изчистване, което води до:
Ea = -mR
Тук знаем, че стойността на m и R е константа, равна на 8.314 J / K · mol.
Как енергията на активиране влияе на скоростта на реакцията?
Когато се опитваме да направим образ на енергията на активиране, той може да се разглежда като бариера, която не позволява да се получи реакция между молекулите с ниска енергия..
Както в общата реакция се случва, че броят на молекулите, които могат да реагират е доста голям, скоростта - и еквивалентно, кинетичната енергия на тези молекули - може да бъде много променлива..
Обикновено се случва само малка част от съвкупността от молекулите, които изпитват сблъсък - тези, които имат по-голяма скорост на движение - дават достатъчно кинетична енергия, за да могат да преодолеят големината на енергията на активиране. Така че, тези молекули са подходящи и способни да бъдат част от реакцията.
Според уравнението на Аррениус, отрицателният знак - който предхожда частното между енергията на активиране и произведението на газовата константа от абсолютната температура - предполага, че константата на скоростта намалява с увеличаване на енергията на активиране, както и растеж при повишаване на температурата.
Примери за изчисляване на енергията на активиране
За да се изчисли енергията на активиране чрез конструиране на графика, съгласно уравнението на Аррениус, имаме, че константи на скоростта за реакцията на разлагане на ацеталдехид са измерени при пет различни температури и искаме да определим енергията на активиране. за реакцията, която се изразява като:
СН3СНО (g) → СН4(g) + СО (g)
Данните от петте измервания са следните:
k (1 / M1/2· S): 0.011 - 0.035 - 0.105 - 0.343 - 0.789
Т (К): 700 - 730 - 760 - 790 - 810
Първо, за да разрешим това неизвестно и да определим енергията на активиране, трябва да изградим графика на ln k vs 1 / T (y vs x), за да получим права линия и от тук да вземем наклона и да намерим стойността на Ea, както е обяснено.
Преобразувайки данните от измерванията, съгласно уравнението на Аррениус [ln k = (- Ea / R) (1 / T) + ln A] се откриват следните стойности за y и x, съответно:
в: (-4,51) - (-3,35) - (-2,254) - (-1,070) - (-0,237)
1 / T (К-1): 1.43 * 10-3 - 1.37 * 10-3 - 1.32 * 10-3 - 1,27 * 10-3 - 1,23 * 10-3
От тези стойности и чрез математическото изчисление на наклона - или в компютър, или в калкулатор, с помощта на израза m = (Y)2-и1) / (X2-X1) или използвайки метода на линейна регресия - получаваме, че m = -Ea / R = -2.09 * 104 К. Така че:
Ea = (8.314 J / K · mol) (2.09 * 10)4 K)
= 1.74 * 105 = 1.74 * 102 kJ / mol
За да се определят други енергии на активиране чрез графичен начин, се извършва подобна процедура.
препратки
- Wikipedia. (Н.О.). Енергия за активиране. Изтеглено от en.wikipedia.org
- Chang, R. (2007). Химия, Девето издание. Мексико: McGraw-Hill.
- Britannica, Е. (s.f.). Активираща енергия. Изтеглено от britannica.com
- Moore, J.W. и Pearson, R.G. (1961). Кинетика и механизъм. Получено от books.google.co.ve
- Kaesche, H. (2003). Корозия на металите: физикохимични принципи и настоящи проблеми. Получено от books.google.co.ve


