Етанова структура, свойства, употреби и рискове
на етан е прост въглеводород с формула С2Н6 с характер на безцветен и без мирис газ, който има много ценна и разнообразна употреба в синтеза на етилен. В допълнение, това е един от земните газове, които също са били открити в други планети и звездни тела около Слънчевата система. Той е открит от учения Майкъл Фарадей през 1834 година.
Сред големия брой органични съединения, образувани от въглеродни и водородни атоми (известни като въглеводороди), има такива, които са в газообразно състояние при температури и натиск върху околната среда, които се използват изключително в много индустрии..
Те обикновено идват от газообразната смес, наречена "природен газ", продукт с висока стойност за човечеството, и съставлява метан тип метан, етан, пропан и бутан, между другото; класифицирани според количеството въглеродни атоми в неговата верига.
индекс
- 1 Химическа структура
- 1.1 Синтез на етан
- 2 Свойства
- 2.1 Разтворимост на етан
- 2.2 Кристализация на етан
- 2.3 Изгаряне на етан
- 2.4 Етан в атмосферата и в небесните тела
- 3 Използване
- 3.1 Производство на етилен
- 3.2 Обучение на основни химикали
- 3.3 Хладилен агент
- 4 Рискове от етан
- 5 Препратки
Химическа структура
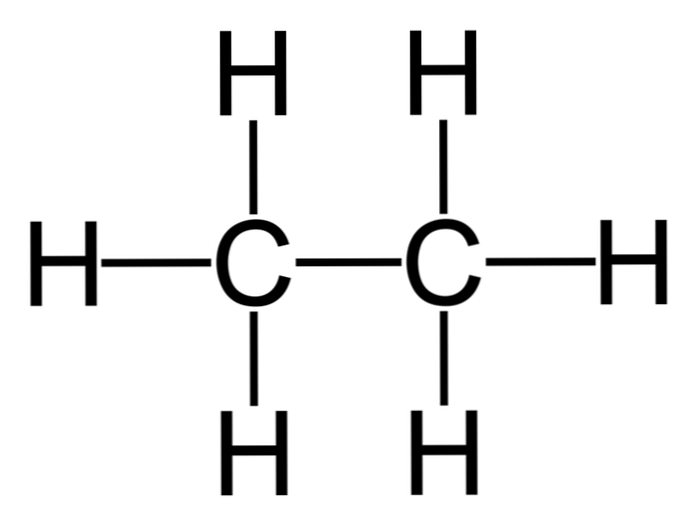
Етанът е молекула с формула С2Н6, обикновено се разглежда като обединение на две метилови групи (-СН3) за образуване на въглеводород от проста връзка въглерод-въглерод. Също така е най-простото органично съединение след метана, представено по следния начин:
Н3C-CH3
Въглеродните атоми в тази молекула притежават sp хибридизация3, така молекулярните връзки представляват свободно въртене.
Също така има присъщо явление на етан, което се основава на въртенето на молекулярната структура на същото и на минималната енергия, необходима за произвеждане на ротация на връзката от 360 градуса, което учените наричат "етан бариера".
Поради тази причина, етанът може да се появи в различни конфигурации в зависимост от неговото въртене, въпреки че неговата по-стабилна конформация съществува там, където водородите са противоположни един на друг (както е показано на фигурата).

Синтез на етан
Етанът може лесно да се синтезира от електролизата на Колбе, органична реакция, в която се случват два етапа: електрохимично декарбоксилиране (отстраняване на карбоксилната група и освобождаване на въглероден диоксид) на две карбоксилни киселини и комбинацията от продукти. междинни съединения за образуване на ковалентна връзка.
По подобен начин електролизата на оцетната киселина води до образуването на етан и въглероден диоксид и тази реакция се използва за синтезиране на първата.
Окисляването на оцетния анхидрид чрез действието на пероксиди, концепция, подобна на тази на електролизата на Колбе, също води до образуването на етан.
По същия начин, той може да бъде ефективно отделен от природен газ и метан чрез процес на втечняване, използвайки криогенни системи за улавяне на този газ и отделянето му от смеси с други газове..
Процесът на турборазширяване е предпочитан за тази роля: газовата смес се пропуска през турбина, генерирайки нейното разширение, докато температурата му падне под -100 ° С.
Още в този момент компонентите на сместа могат да бъдат диференцирани, така че течният етан да бъде отделен от газовия метан и другите видове, участващи в дестилацията..
свойства
Етанът се среща в природата като безцветен газ без мирис при стандартни налягания и температури (1 atm и 25 ° C). Температурата на кипене е -88.5 ° С и температурата на топене -182.8 ° С. Освен това, той не се влияе от излагане на силни киселини или основи.
Разтворимост в етанол
Молекулите на етана са със симетрична конфигурация и имат слаби сили на привличане, които ги държат заедно, наречени сили на дисперсията.
Когато се опита да се разтвори етан във вода, силите на привличане, образувани между газа и течността, са много слаби, така че е много трудно да се присъедини към етан с водни молекули..
По тази причина разтворимостта на етан е значително ниска, като се увеличава леко, когато налягането в системата се повиши.
Кристализация на етан
Етанът може да бъде втвърден, което води до образуването на нестабилни кристали етан с кубична кристална структура.
С понижаване на температурата над -183,2 ° С, тази структура става моноклинна, увеличавайки стабилността на неговата молекула.
Изгаряне на етан
Този въглеводород, въпреки че не се използва широко като гориво, може да се използва в горивни процеси за генериране на въглероден диоксид, вода и топлина, което е представено по следния начин:
2С2Н6 + 7o2 → 4CO2 + 6Н2O + 3120 kJ
Съществува също така възможността за изгаряне на тази молекула без излишък на кислород, който е известен като "непълно изгаряне" и който води до образуване на аморфен въглерод и въглероден оксид в нежелана реакция, в зависимост от количеството на прилагания кислород. :
2С2Н6 + 3О2 → 4C + 6H2О + топлина
2С2Н6 + 4о2 → 2С + 2СО + 6Н2О + топлина
2С2Н6 + 5О2 → 4CO + 6H2О + топлина
В тази област горенето се осъществява чрез серия от реакции на свободни радикали, които са номерирани в стотици различни реакции. Например, съединения като формалдехид, ацеталдехид, метан, метанол и етанол могат да се образуват при непълни реакции на горене..
Това ще зависи от условията, при които се осъществява реакцията и участват реакциите на свободните радикали. Етиленът може да се образува и при високи температури (600-900 ° C), което е продукт, който е силно желан от индустрията.
Етан в атмосферата и небесните тела
Етанът присъства в атмосферата на планетата Земя в следи и се предполага, че човекът е успял да удвои тази концентрация, откакто е започнал да практикува промишлени дейности..
Учените смятат, че голяма част от настоящото присъствие на етан в атмосферата се дължи на изгарянето на изкопаеми горива, въпреки че глобалните емисии на етан са намалели почти наполовина, тъй като технологиите за производство на шистов газ са подобрени ( източник на природен газ).
Този вид се произвежда и естествено от действието на слънчевите лъчи върху атмосферния метан, който рекомбинира и образува молекула етан..
Етанът съществува в течно състояние на повърхността на Титан, една от спътниците на Сатурн. Това се случва в по-голямо количество в река Вит Флумина, която тече повече от 400 километра към едно от своите морета. Също така е доказано това съединение върху комети и на повърхността на Плутон.
приложения
Производство на етилен
Употребата на етан се основава главно на производството на етилен, най-широко използвания биологичен продукт в световното производство, чрез процес, известен като крекинг на пара..
Този процес се състои в преминаване на фураж от етан, разреден с пара в пещ, като се нагрява бързо без кислород.
Реакцията протича при изключително висока температура (между 850 и 900 ° С), но времето на престой (времето, прекарано от етана във фурната) трябва да бъде кратко, за да бъде реакцията ефективна. При по-високи температури се генерира повече етилен.
Обучение на основни химикали
Етанът също е изследван като основен компонент при образуването на основни химикали. Окислителното хлориране е един от процесите, предложени за получаване на винилхлорид (компонент от PVC), който замества по-евтини и по-сложни..
охладителен
Накрая, етанът се използва като хладилен агент в общите криогенни системи, като също така показва способността за замразяване на малки проби в лабораторията за анализ..
Той е много добър заместител на водата, която отнема повече време за охлаждане на деликатните проби и може да генерира образуването на вредни ледени кристали..
Рискове за етан
-Етанът има способността да се запалва, особено когато се свързва с въздуха. При проценти от 3,0 до 12,5% обем етан във въздуха може да се образува експлозивна смес.
-Тя може да ограничи кислорода във въздуха, в който се намира, и поради тази причина представлява рисков фактор за задушаване за хора и животни, които присъстват и са изложени.
-Етанът в замразена течна форма може сериозно да изгори кожата, ако влезе в директен контакт с него, а също така действа като криогенна среда за всеки обект, който докосва, замразява го за миг.
-Парите на течния етан са по-тежки от въздуха и са концентрирани на земята, това може да представлява риск от запалване, което може да генерира верижна реакция на горене..
-Поглъщането на етан може да предизвика гадене, повръщане и вътрешно кървене. Вдишването, в допълнение към задушаването, причинява главоболие, объркване и промени в настроението. Смърт, причинена от спиране на сърцето, е възможна при високи експозиции.
-Той представлява парников газ, който, заедно с метана и въглеродния диоксид, допринася за глобалното затопляне и климатичните промени, генерирани от човешкото замърсяване. За щастие, тя е по-малко изобилна и трайна от метана и поглъща по-малко радиация от това.
препратки
- Britannica, Е. (s.f.). Етан. Изтеглено от britannica.com
- Nes, G. V. (s.f.). Еднокристални структури и разпределения на електронна плътност на етан, етилен и ацетилен. Възстановен от rug.nl
- Сайтове, G. (s.f.). Етан: Източници и мивки. Получено от sites.google.com
- SoftSchools. (Н.О.). Формула на етан. Възстановен от softschools.com
- Wikipedia. (Н.О.). Етан. Изтеглено от en.wikipedia.org


