Калциев фосфат (Са3 (РО4) 2) структура, свойства, образуване и приложения
на калциев фосфат е неорганична и третична сол, чиято химична формула е Са3(PO4)2. Формулата заявява, че съставът на тази сол е 3: 2 съответно за калций и фосфат. Това може да се види директно в долната част на изображението, където се показва катионът2+ и анион РО43-. За всеки три Са2+ Има две ПО43- взаимодейства с тях.
От друга страна, калциевият фосфат се отнася до серия от соли, които варират в зависимост от съотношението Са / Р, както и от степента на хидратация и рН. Всъщност съществуват много видове калциеви фосфати, които могат да бъдат синтезирани. Обаче, следвайки буквално номенклатурата, калциевият фосфат се отнася само до трикалциевия, споменат по-горе.

Всички калциеви фосфати, включително Са3(PO4)2, Те са плътно бели с леко сиви тонове. Те могат да бъдат гранулирани, фини, кристални и да имат размери на частиците, които са около микрометри; и дори са приготвени наночастици от тези фосфати, с които са проектирани биосъвместими материали за костите.
Тази биосъвместимост се дължи на факта, че тези соли се намират в зъбите и, накратко, в костните тъкани на бозайниците. Например, хидроксиапатит е кристален калциев фосфат, който от своя страна взаимодейства с аморфна фаза на същата сол..
Това означава, че съществуват аморфни и кристални калциеви фосфати. Поради тази причина разнообразието и множеството опции не са изненадващи, когато се синтезират материали на основата на калциеви фосфати; материали, в чиито свойства изследователите са по-заинтересовани всеки ден по света да се съсредоточат върху възстановяването на костите.
индекс
- 1 Структура на калциев фосфат
- 1.1 Аморфен калциев фосфат
- 1.2 Останалата част от семейството
- 2 Физични и химични свойства
- 2.1 Имена
- 2.2 Молекулно тегло
- 2.3 Физическо описание
- 2.4 Вкус
- 2.5 Точка на топене
- 2.6 Разтворимост
- 2.7 Плътност
- 2.8 Индекс на пречупване
- 2.9 Стандартна енталпия на обучението
- 2.10 Температура на съхранение
- 2.11 рН
- 3 Обучение
- 3.1 Калциев нитрат и амониев хидроген фосфат
- 3.2 Калциев хидроксид и фосфорна киселина
- 4 Използване
- 4.1 В костната тъкан
- 4.2 Биокерамични цименти
- 4.3 Лекари
- 4.4 Други
- 5 Препратки
Структура на калциев фосфат
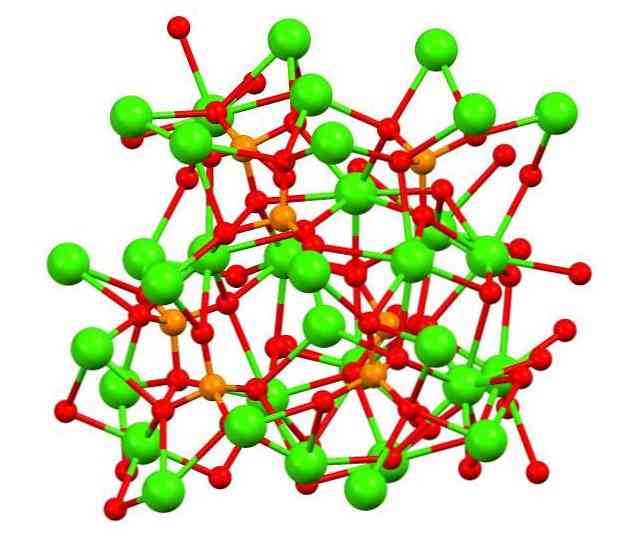
Горното изображение показва структурата на триосновния каликофосфат в странния минерал, който може да съдържа магнезий и желязо като примеси..
Въпреки че на пръв поглед може да изглежда сложно, е необходимо да се изясни, че моделът предполага ковалентни взаимодействия между кислородните атоми на фосфатите и металните центрове на калция..
Чрез представяне е валидно, но взаимодействията са електростатични; това е, катиони Са2+ са привлечени от PO аниони43- (Са2+- О-РО33-). Като се има предвид това, се разбира защо в образа калций (зелени сфери) са заобиколени от отрицателно заредени кислородни атоми (червени сфери).
Когато има толкова много йони, тя не оставя видима симетрична подредба или модел. Са3(PO4)2 Приема при ниски температури (Т<1000°C) una celda unitaria correspondiente a un sistema cristalino romboédrico; a este polimorfo se le conoce con el nombre de β-Ca3(PO4)2 (β-TCP, акроним на английски).
При високи температури, от друга страна, той се трансформира в полиморфния α-Ca3(PO4)2 (α-TCP), чиято единична клетка съответства на моноклинна кристална система. При още по-високи температури може да се образува и полиморфът α'-Ca3(PO4)2, което е от хексагонална кристална структура.
Аморфен калциев фосфат
Споменати са кристални структури за калциев фосфат, което се очаква от сол. Въпреки това, той е способен да проявява разстройства и асиметрични структури, свързани повече с тип "калциево фосфатно стъкло", отколкото с кристали в строгия смисъл на неговото определение..
Когато това се случи, се казва, че калциевият фосфат има аморфна структура (АКТ, аморфен калциев фосфат). Няколко автори посочват този тип структура като отговорен за биологичните свойства на Са3(PO4)2 в костните тъкани, нейният ремонт и биомиметизацията са възможни.
Чрез изясняване на нейната структура чрез ядрено-магнитен резонанс (ЯМР) е открито присъствието на ОН-йони- и HPO42- в АКТБ. Тези йони се образуват чрез хидролиза на един от фосфатите:
PO43- + Н2О <=> НРО42- + OH-
В резултат на това истинската структура на АКТБ става по-сложна, чийто състав на йони се представя с формулата: Са9(PO4)6-х(НРО4)х(ОН)х. "X" показва степента на хидратация, тъй като ако x = 1, тогава формулата ще бъде като: Ca9(PO4)5(НРО4) (OH).
Различните структури, които PCA може да зависи от моларните съотношения Ca / P; т.е. на относителните количества калций и фосфати, които променят целия техен получен състав.
Останалата част от семейството
Калциевите фосфати са всъщност семейство от неорганични съединения, които от своя страна могат да взаимодействат с органична матрица.
Другите фосфати се получават "просто" чрез промяна на анионите, които придружават калция (РО43-, НРО42-, Н2PO4-, OH-), както и вида на примесите в твърдото вещество. Така до единадесет калциеви фосфата или повече, всяка със собствена структура и свойства, могат да произхождат естествено или изкуствено..
По-долу са дадени някои фосфати и техните съответни структури и химични формули:
-Водороден калциев фосфат дихидрат, CaHPO42Н2О: моноклинна.
-Калциев дихидроген фосфат монохидрат, Са (Н)2PO4)2Н2О: триклинична.
-Безводен диацид фосфат, Са (Н)2PO4)2: триклинична.
-Калциев хидроген фосфат (OCP), Са8Н2(PO4)6: триклинична Той е прекурсор в синтеза на хидроксиапатит.
-Хидроксиапатит, Са5(PO4)3ОН: хексагонална.
Физични и химични свойства
имена
-Калциев фосфат
-Трикалциев фосфат
-Трикалциев дифосфат
Молекулно тегло
310,74 g / mol.
Физическо описание
Това е бяло твърдо вещество без мирис.
вкус
безвкусен.
Точка на топене
1670 ºK (1391 ºC).
разтворимост
-Практически неразтворим във вода.
-Неразтворим в етанол.
-Разтворим в разредена солна киселина и азотна киселина.
плътност
3.14 g / cm3.
Индекс на пречупване
1629
Стандартна енталпия на обучението
4126 kcal / mol.
Температура на съхранение
2-8 ° С.
рН
6-8 във водна суспензия от 50 g / L калциев фосфат.
обучение
Калциев нитрат и водороден амониев фосфат
Съществуват множество методи за получаване или образуване на калциев фосфат. Един от тях се състои от смес от две соли, Ca (NO)3)24Н2О и (NH4)2НРО4, предварително разтворен в абсолютен алкохол и съответно във вода. Една сол осигурява калций, а другият фосфат.
От тази смес ACP се утаява, която след това се подлага на нагряване в пещ при 800 ° С и в продължение на 2 часа. В резултат на тази процедура се получава β-Ca3(PO4)2. Чрез внимателно контролиране на температурите, времето на разбъркване и времето за контакт може да се получи образуване на нанокристали.
За образуване на полиморфа α-Ca3(PO4)2 необходимо е фосфатът да се нагрява над 1000 ° С. Това нагряване се извършва в присъствието на други метални йони, които стабилизират този полиморф достатъчно, за да може да се използва при стайна температура; т.е. тя остава в стабилно мета състояние.
Калциев хидроксид и фосфорна киселина
Калциевият фосфат може да се образува и чрез смесване на разтворите на калциев хидроксид и фосфорна киселина с киселинно-базисна неутрализация. След половин ден на зреене в матерните луги и тяхното правилно филтриране, промиване, сушене и пресяване се получава гранулиран прах от аморфен фосфат, АКТ.
Това ACP реакции продукт на високи температури, трансформиране в съответствие със следните химически уравнения: \ t
2Ca9(НРО4) (PO4)5(OH) => 2Ca9(P2О7)0.5(PO4)5(ОН) + Н2О (при Т = 446.60 ° С)
2Ca9(P2О7)0.5(PO4)5(OH) => 3Ca3(PO4)2 + 0.5 H2О (при Т = 748.56 ° С)
По този начин се получава р-Са3(PO4)2, най-често срещаният и стабилен полиморф.
приложения
В костната тъкан
Са3(PO4)2 Той е основната неорганична съставка на костната пепел. Той е компонент на трансплантациите за костна заместител, което се обяснява с химическото му сходство с минералите в костта.
Биоматериалите от калциев фосфат се използват за коригиране на костни дефекти и за покриване на метални протези от титан. На тях се отлага калциев фосфат, който ги изолира от околната среда и забавя процеса на титанова корозия.
Калциеви фосфати, включително Са3(PO4)2, Използват се за производство на керамични материали. Тези материали са биосъвместими и понастоящем се използват за възстановяване на загубата на алвеоларна костна тъкан в резултат на пародонтоза, ендодонтски инфекции и други състояния..
Въпреки това, те трябва да се използват само за ускоряване на периапикалната ремонта на костите в райони, където няма хронична бактериална инфекция.
Калциевият фосфат може да се използва за възстановяване на костни дефекти, когато не е възможно да се използва автогенна костна присадка. Възможно е да се използва самостоятелно или в комбинация с биоразградим и резорбируем полимер, като полигликолова киселина.
Биокерамични цименти
Калциевият фосфат (CPC) е друг биокерамик, използван при възстановяването на костната тъкан. Произвежда се чрез смесване на прах от различни видове калциеви фосфати с вода, образувайки паста. Пастата може да бъде инжектирана или регулирана към костния дефект или кухина.
Циментите се формоват, постепенно се резорбират и заместват с новообразувана кост.
медицински
-Са3(PO4)2 Той е основна сол, така че се използва като антиацид за неутрализиране на излишната стомашна киселина и повишаване на рН. В паста за зъби, тя осигурява източник на калций и фосфати за улесняване на процеса на реминерализация на зъбите и костната хемостаза.
-Той се използва и като хранителна добавка, въпреки че най-евтиният начин за замяна на калция е чрез използването на неговия карбонат и цитрат..
-Калциевият фосфат може да се използва за лечение на тетания, латентна хипокалциемия и поддържаща терапия. В допълнение, той е полезен при калциеви добавки по време на бременност и кърмене.
-Използва се за лечение на замърсяване с радиоактивни изотопи радио (Ra-226) и стронций (Sr-90). Калциевият фосфат блокира абсорбцията на радиоактивни изотопи в храносмилателния тракт, ограничавайки по този начин щетите, причинени от тях.
други
-Калциевият фосфат се използва като храна за птиците. В допълнение, той се използва в пасти за зъби за контрол на зъбен камък.
-Използва се като агент против слепване, например за предотвратяване на уплътняването на готварската сол.
-Работи като избелващо средство за брашно. Докато, в свинската мас свинята предотвратява нежелано оцветяване и подобрява състоянието на пърженето.
препратки
- Tung M.S. (1998) Калциеви фосфати: структура, състав, разтворимост и стабилност. В: Amjad Z. (eds) Калциеви фосфати в биологични и индустриални системи. Springer, Boston, MA.
- Langlang Liu, Yanzeng Wu, Chao Xu, Suchun Yu, Xiaopei Wu и Honglian Dai. (2018). "Синтез, характеризиране на нано-р-трикалциев фосфат и инхибиране на хепатоцелуларни карциномни клетки", Journal of Nanomaterials, vol. 2018, артикул ID 7083416, 7 страници, 2018.
- Бои, Христос и Рей, християнин. (2010 г.). Аморфни калциеви фосфати: синтез, свойства и приложения в биоматериали. Acta Biomaterialia, vol. 6 (n ° 9). стр. 3362-3378. ISSN 1742-7061
- Wikipedia. (2019). Трикалциев фосфат. Изтеглено от: en.wikipedia.org
- Abida et al. (2017). Трикалциев фосфат на прах: способности за приготвяне, характеризиране и уплътняване. Mediterranean Journal of Chemistry 2017, 6 (3), 71-76.
- PubChem. (2019). Калциев фосфат. Възстановен от: pubchem.ncbi.nlm.nih.gov
- Elsevier. (2019). Калциев фосфат. Science Direct. Възстановен от: sciencedirect.com


