Свойства, реактивност и употреба на калциев хидрид (CaH2)
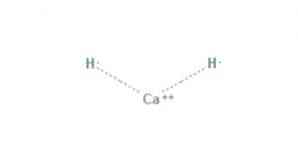
на калциев хидрид е химично съединение с формула CaH2, което го прави алкалоземен хидрид. Това химично съединение има две йонни връзки между калция и двата хидридни йона, както е показано на фигура 1.
Това е физиологичен хидрид, което означава, че неговата структура е подобна на солта. Нейната кристална структура е същата като тази на оловен хлорид (Cotunnite mineral), както е показано на фигура 2.

Всички алкални и алкалоземни метали образуват хидридни соли. В химия, хидрид е водороден анион, Н- или, по-често, съединение, в което един или повече водородни центрове имат нуклеофилни, редуциращи или основни свойства.
В съединения, които се считат за хидриди, водородният атом е свързан към по-електропозитивен елемент или група.
Той може да бъде получен чрез взаимодействие на калций и водород при температура между 300 и 400 градуса по Целзий. Друг начин за приготвяне на калциев хидрид е нагряване на калциевия хлорид заедно с водород и натриев метал. Реакцията се извършва по следния начин:
CaCl2 + H2 + 2Na → CaH2 + 2NaCl
В тази реакция калций (Са) и водород (Н) създават молекула калциев хидрид, докато натриевите атоми заедно с хлор създават молекули натриев хлорид (NaCl)..
Калциев хидрид може да се получи и чрез намаляване на калциевия оксид (CaO) с магнезий (Mg). Реакцията се провежда в присъствието на водород. Тази реакция също произвежда магнезиев оксид (MgO). По-долу е формулата за тази химична реакция:
CaO + Mg + H2 → CaH2 + MgO
индекс
- 1 Физични и химични свойства на калциевия хидрид
- 2 Реактивност и опасности
- 3 Работа и съхранение
- 4 Употреби и приложения
- 4.1 Сушилен агент
- 4.2 Производство на водород
- 4.3 Редуциращ агент
- 5 Недостатък при използването на калциев хидрид
- 6 Препратки
Физични и химични свойства на калциевия хидрид
Калциевият хидрид е набор от кристали с бяла орторомбична структура, когато е чиста. Като цяло, рядко се намира в тази форма, така че обикновено има сивкав оттенък. Липсва характерна миризма. Външният му вид е показан на фигура 3 (Royal Society of Chemistry, 2015).

Той има молекулно тегло 42,094 g / mol, има точка на топене 816 градуса по Целзий и плътност 1,70 g / ml. Ако се разтвори във вода, тя реагира бурно, създавайки водород. Той реагира и с алкохол (Национален център за биотехнологична информация, S.F.).
Реактивност и опасности
Калциевият хидрид е стабилен химикал, въпреки че е силно реактивен към вода или влага. При контакт с вода, той освобождава запалими газове от водород, които могат да се възпламенят спонтанно.
Счита се за експлозивно съединение. Когато се загрява в реакция с тетрахидрофуран, тя може да предизвика експлозия. Когато се смесва с хлорат, хипохлорит, бромат, калиев перхлорат, той става чувствителен към топлина, триене и става експлозивен (Calcium Hydride 7789-78-8, 2016).
Когато сребърният флуорид се раздробява с калциев хидрид, масата става нажежаема. Силното нагряване на хидрида с хлор, бром или йод води до накаляване.
Смеси на хидрида с различни бромати, например бариев бромат или хлорати, например бариев хлорат и перхлорати, като калиев перхлорат, се взривяват при раздробяване. CaH2 реагира с нажежаема жичка със сребърен флуорид, ако е подложен на триене.
Това съединение трябва да се обработва в инертна атмосфера. Ако не се работи правилно, това може да представлява сериозна заплаха за здравето и безопасността на лабораторния персонал, спасителите и манипулаторите за химически отпадъци (UC център за лабораторна безопасност, 2013).
Изключително опасен в случай на контакт с кожата или очите, тъй като е дразнещ. Много опасно в случай на контакт с кожата, защото може да бъде корозивно.
Той е също опасен в случай на поглъщане и вдишване. Количеството увреждане на тъканта зависи от дължината на контакта. Контактът с очите може да доведе до увреждане на роговицата или слепота.
Контактът с кожата може да предизвика възпаление и мехури. Вдишването на прах ще предизвика дразнене на стомашно-чревния или дихателния тракт, характеризиращо се с изгаряне, кихане и кашлица..
Тежкото преекспониране може да причини увреждане на белите дробове, задушаване, безсъзнание и дори смърт. Възпалението на окото се характеризира с зачервяване, дразнене и сърбеж. Възпалението на кожата се характеризира със сърбеж, пилинг, зачервяване или понякога мехури.
Многократното излагане на очите на ниско ниво може да предизвика дразнене на очите. Повтарящото се излагане на кожата може да причини локално разрушаване на кожата или дерматит.
Многократното вдишване на прах може да доведе до различна степен на дразнене на дихателните пътища или увреждане на белите дробове. Многократно или продължително вдишване на прах може да причини хронично дразнене на дихателните пътища (Информационен лист за безопасност на калциевия хидрид MSDS, 2005).
В случай на контакт с очите, те трябва незабавно да се изплакнат обилно с вода в продължение на най-малко 15 минути, като понякога се вдигат горните и долните клепачи.
В случай на контакт с кожата трябва незабавно да се изплакне обилно с вода в продължение на най-малко 15 минути, докато се отстраняват замърсени дрехи и обувки.
В случай на поглъщане, не трябва да се предизвиква повръщане. Трябва да се нарича център за контрол на отрови. Препоръчително е да напуснете изложбената площадка и да се преместите веднага на открито.
В случай на вдишване, ако дишането е затруднено, е необходимо да се достави кислород. Дишането в устата в устата не трябва да се прилага, ако жертвата е погълнала или вдишала веществото.
Изкуственото дишане трябва да се индуцира с помощта на джобна маска, снабдена с еднопосочен вентил или друго подходящо респираторно медицинско устройство. Във всички случаи трябва незабавно да се получи медицинска помощ.
Работа и съхранение
Съединението трябва да се съхранява в сух контейнер, далеч от топлина. Трябва да се пази от източници на запалване. Не вдишвайте прах. Не трябва да се добавя вода към този продукт
В случай на недостатъчна вентилация, носете подходящи дихателни средства като филтърна маска. В случай на експозиция, трябва да потърсите лекарска помощ и да покажете етикета колкото е възможно повече. Избягвайте контакт с кожата и очите.
Запалимите материали по принцип трябва да се съхраняват в отделен шкаф за сигурност или в складово помещение. Съхранявайте контейнера плътно затворен.
Да се съхранява на хладно и добре проветриво място. Цялото оборудване, съдържащо материал за избягване на електрически искри, трябва да бъде заземено. Контейнерът трябва да се съхранява на сухо и на хладно място.
Това е негорим материал. Въпреки това пожарникарите трябва да носят подходящо оборудване, докато гасят пожар около това химично съединение.
Никога не е препоръчително да се използва вода за гасене на пожар около калциевия хидрид. За тази цел може да се използва сух пясък, както и съединения като натриев хлорид и натриев карбонат.
За да се отстранят отпадъците от калциев хидрид, той трябва да се разложи чрез добавяне на 25 ml метанол за всеки грам хидрид в азотна атмосфера при разбъркване..
След като реакцията приключи, същият обем вода се добавя към водното съединение на калциев метоксид и се изхвърля в канализацията с обилно количество вода (National Research Council, 1995)..
Употреби и приложения
Десикант
Калиев хидрид е относително мек сушител. Поради тази причина, използването на това съединение като десикант е по-безопасно в сравнение с повече реактивоспособни агенти, такива като натриево-калиеви и натриеви метални сплави. Реагира с вода по следния начин:
СаН2 + 2 Н20> Са (ОН) 2 + 2 Н2
Продуктите на хидролизата на тази реакция, водород (газ) и Са (ОН) 2 (водна смес), могат да бъдат отделени от химичния разтворител след филтрация, дестилация или процес на декантиране..
Това химично съединение е ефективно изсушител за много основни разтворители като амини и пиридин. Понякога се използва за предварително изсушаване на разтворителите, преди да се използват повече реактивни десиканти.
Производство на водород
През 40-те години това съединение е било достъпно като източник на водород под търговското наименование "Hydrolith".
Той е бил използван като източник на водород за дълго време. Той все още се използва за производство на чист водород в лаборатории за различни експерименти, модерни горивни клетки и приложения за батерии (American Elements, S.F.).
Съединението се използва от десетилетия като безопасно и удобно средство за надуване на метеорологичните балони.
По същия начин, той се използва редовно в лаборатории за производство на малки количества високо чист водород за експерименти. Съдържанието на влага в дизеловото гориво се изчислява чрез образуване на водород след обработка с CaH2.
Редуциращ агент
При нагряване между 600 и 1000 градуса по Целзий циркониевият оксид, ниобий, уран, хром, титан, ванадий и тантал могат да бъдат намалени, за да се приготви прахът от тези метали, така че калциевият хидрид да може да се използва в металургията. прах.
Следващата реакция илюстрира начина, по който калциевият хидрид действа като редуциращ агент:
TiO + 2CaH2 → CaO + H2 + Ti
Недостатък при употребата на калциев хидрид
Това химично съединение често е предпочитаният избор като сушилен агент; Но има и някои недостатъци:
-Сушилното действие на това съединение е бавно, тъй като не е разтворимо във всеки разтворител, с който не реагира бурно.
-Това прахообразно съединение е несъвместимо с много разтворители. Вашата реакция с хлорокарбони може дори да причини експлозии.
-Не може да се използва за деоксигениращи разтворители, тъй като не е в състояние да елиминира разтворен кислород.
-Разграничаването между калциев хидрид и калциев хидроксид е доста трудно поради сходните му проявления.
препратки
- Американски елементи. (S.F.). калциев хидрид. Взето от americanelements.com: americanelements.com.
- Калциев хидрид 7789-78-8. (2016 г.). Изтеглено от chemicalbook.com: chemicalbook.com.
- калциев хидрид. (Н.О.). Възстановен от учител по химия: chemistrylearner.com.
- Информационен лист за безопасност Калциев хидрид MSDS. (2005, 10 октомври). Взето от sciencelab.com: sciencelab.com.
- Национален център за биотехнологична информация. (S.F.). PubChem Compound Database; CID = 105052. Получено от pubchem.ncbi.nlm.nih.gov: pubchem.ncbi.nlm.nih.gov.
- национален изследователски съвет. (1995). Разумни практики в лабораторията: обработка и изхвърляне на химикали. Washinton: NationalAcademy Press.
- Кралско химическо дружество. (2015). калциев хидрид ID 94784. Изтеглено от chemspider.com: chemspider.com.
- UC център за лабораторна безопасност. (2013 г., 18 януари). стандартна операционна процедура калциев хидрид. Получено от chemengr.ucsb.edu: chemengr.ucsb.edu.


