Магнезиева хидридна формула, химична структура и свойства
на магнезиев хидрид (MGH2 с молекулна формула), е химично съединение с тегловно съдържание на водород 7,66% и се намира в природата като бяло кристално твърдо вещество. Използва се главно за приготвяне на други химически вещества, въпреки че също е изследвана като потенциална среда за съхранение на водород.
Той принадлежи към семейството на физиологични (или йонни) хидриди, онези, дефинирани от Н-йон отрицателно заредени. Тези хидриди се считат за онези, които се образуват от алкални метали и алкалоземни метали, но в случая на магнезий (и берилий) имат ковалентни връзки, в допълнение към тези йони, които характеризират това семейство хидриди..
индекс
- 1 Препарат и формула
- 2 Химическа структура
- 3 Физични и химични свойства
- 3.1 Физически
- 3.2 Химикали
- 4 Използване
- 4.1 Съхранение на водород
- 4.2 Реакции на хидрогениране и дехидрогениране
- 4.3 Кал
- 4.4 Горивни клетки
- 4.5 Транспорт и енергетика
- 4.6 Алкилиране
- 5 Рискове
- 5.1 Реакция с вода
- 5.2 То е пирофорно
- 6 Препратки
Подготовка и формула
Магнезиевият хидрид се образува чрез директно хидриране на магнезиев (Mg) метал при условия на високо налягане и температура (200 атмосфери, 500 ° С) с MgI катализатор.2. Неговата реакция е еквивалентна на:
Mg + H2→ MgH2
Производството на MgH също е изследвано2 при по-ниски температури с използването на нанокристален магнезий, произведен в топкови мелници.
Съществуват и други методи за приготвяне, но те представляват по-сложни химични реакции (хидрогениране на магнезиев антрацен, реакция между диетилмагнезий с литиево-алуминиев хидрид и като продукт на комплекс от MgH).2).
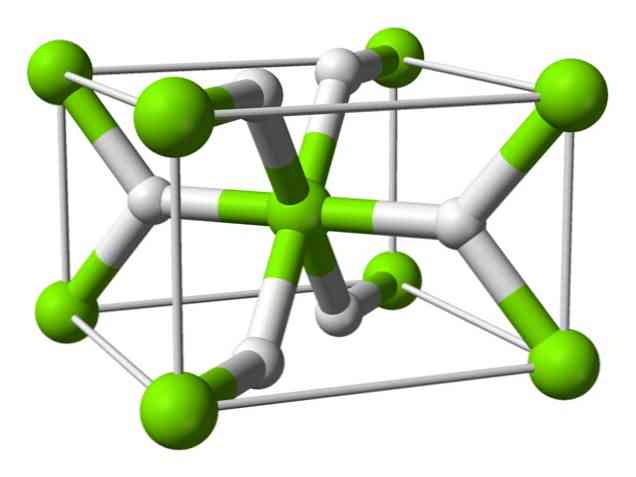
Химическа структура
Този атом има структура на рутил при стайна температура, с тетрагонална кристална структура. Той има най-малко четири различни форми при условия на високо налягане и също така е наблюдавана нестехиометрична структура с недостиг на водород; последното се появява само в много малки количества частици, когато се образува.
Както е споменато по-горе, връзките, които съществуват в рутиловата структура, имат частично ковалентни свойства, вместо да са чисто йонни, подобно на други солени хидриди..
Това причинява магнезиевия атом да има сферична форма, напълно йонизиран, но неговият хидриден йон има продълговата структура.
Физични и химични свойства
физически
- Външен вид: Бели кристали.
- Моларна маса: 26,3209 g / mol
- Плътност: 1.45 g / cm3
- Точка на топене: 285 ° С се разлага
- Разтворимост: във вода се разлага.
Това химично съединение има молекулно тегло 26,321 g / mol, плътност 1,45 g / cm3 и има точка на топене 327 ° С..
химически
- Прекурсор за производството на други химически вещества.
- Съхранение на водород, като възможен източник на енергия.
- Редуциращ агент в органичния синтез.
Важно е да се посочи, че това съединение не може да бъде доведено до течно състояние, а когато се пренася или неговата точка на топене или въведено във вода, то се разлага. Този хидрид е неразтворим в етер.
Той е високо реактивно и лесно запалимо вещество и също е пирофорно, т.е. може да се запали спонтанно във въздуха. Тези три условия представляват рискове за сигурността, които ще бъдат споменати в последния раздел на тази статия.
приложения
Съхранение на водород
Магнезиевият хидрид реагира лесно с вода, за да образува водороден газ, чрез следната химическа реакция:
MGH2+2H2О → 2Н2+Mg (OH)2
Освен това, това вещество се разлага при температура 287 ° C и налягане 1 bar, както следва: \ t
MGH2→ Mg + H2
Поради това беше предложено използването на магнезиев хидрид като водородна среда за съхранение за неговото използване и транспортиране.
Предлага се хидрогениране и дехидрогениране на количество метален магнезий като начин за транспортиране на количества газообразен водород, като по този начин се гарантира, че няма изтичане в неговия транспорт и представлява по-безопасен и по-практичен начин, отколкото с използването на съдове с високо налягане..
Реакции на хидрогениране и дехидриране
Въпреки че температурата на разлагане на магнезиев хидрид представлява ограничаващ фактор за нейното използване, са предложени методи за подобряване на кинетиката на реакциите на хидрогениране и дехидриране. Едно от тях е намаляването на размера на магнезиевите частици с използването на топкови мелници.
кал
Освен това е предложена система, която произвежда магнезиев хидрид под формата на кал (по-управляеми и безопасни от тези в прах или други твърди частици), които биха реагирали с вода за получаване на желания водород..
Изчислено е, че преди това утайката ще бъде образувана от фино смлян хидрид, защитен със защитен слой от масла и суспендиран в диспергиращи агенти, за да се гарантира, че той запазва своята консистенция без загуба на материал и че не абсорбира влагата от околната среда..
Тази утайка има предимството, че може да се изпомпва през всяка обща дизелова, бензинова или водна помпа, като прави това икономично предложение, както и ефективно.
Горивни клетки
Магнезиевият хидрид може да бъде внедрен в производството на съвременни горивни клетки, както и в създаването на батерии и съхранение на енергия.
Транспорт и енергия
През последните десетилетия се разглежда използването на водород като енергиен източник. Имплантацията на водород като гориво изисква намирането на безопасни и обратими системи за съхранение и с високи обеми на капацитета (количество водород на единица обем) и гравиметрично (количество водород на единица маса).
алкилиране
Алкилиране (добавяне на СН алкилови групи3R) на органични съединения в основна среда, където има присъствие на -ОН групи при ниски концентрации и температури, по-високи от точката на топене на хидрида.
В този случай водородите, присъстващи в магнезиев хидрид (MgH2), се свързват с -ОН групите, образуващи вода. Свободният магнезий може да получи халоген, който често придружава алкидната молекула, която е предназначена да се свързва с въглеводородната верига..
рискове
Реакция с вода
Както вече споменахме, магнезиевият хидрид е вещество, което реагира много лесно и бурно с вода, което е способно да експлодира при по-високи концентрации..
Това се случва, защото неговата екзотермична реакция генерира достатъчно топлина за запалване на водородния газ, отделящ се при реакцията на разлагане, което води до доста опасна верижна реакция..
То е пирофорно
Магнезиевият хидрид е също пирофорн, което означава, че може да се запали спонтанно в присъствието на влажен въздух и образува магнезиев оксид и вода..
Не се препоръчва вдишването му в твърдо състояние или в контакт с неговите пари: веществото в естествено състояние и продуктите от разлагането му могат да причинят тежки наранявания или дори смърт..
Той може да генерира корозивни разтвори при контакт с вода и замърсяване. Не се препоръчва контакт с кожата и очите, а също така предизвиква дразнене на лигавиците.
Не е доказано, че магнезиевият хидрид може да генерира хронични ефекти върху здравето, като рак, репродуктивни дефекти или други физически или психически последици, но се препоръчва използването на предпазни средства (особено респиратори или маски) фин прах).
При работа с това вещество, влажността на въздуха трябва да се поддържа на ниски нива, да се гасят всички източници на запалване и да се транспортира в барабани или други контейнерни контейнери..
Винаги трябва да избягвате работа с големи концентрации на това вещество, когато това може да се избегне, тъй като вероятността от експлозия значително намалява.
Ако се получи разливане на магнезиев хидрид, работната зона трябва да се изолира и прахът да се събере с прахосмукачка. Никога не трябва да използвате метода на сухо почистване; увеличава шансовете за реакция с хидрид.
препратки
- Zumdahl, S.S. (1998). Енциклопедия Британика. Взети от britannica.com.
- PubChem. (2005 г.). PubChem Открита база данни за химията. Взето от pubchem.ncbi.nlm.nih.gov.
- Safe Hydrogen, L. (2006). Конгрес на зелените коли. Взети от greencarcongress.com.
- Chemicals, C. (n.d.). Cameo Chemicals. Взето от cameochemicals.noaa.gov.
- Services, N.J. (1987). Министерство на здравеопазването и услугите за възрастни в Ню Джърси. Взето от nj.gov.


