Основи, свойства и недостатъци на теорията на морето на електроните
на електронна теория на електроните Това е хипотеза, която обяснява един изключителен химически феномен, който се среща в металните връзки между елементите с ниска електронегативност. Става въпрос за споделянето на електрони между различни атоми, свързани с метални връзки.
Електронната плътност между тези връзки е такава, че електроните са делокализирани и образуват "море", където те се движат свободно. Тя може да бъде изразена и от квантовата механика: някои електрони (обикновено една до седем за атом) са подредени в орбитали с множество центрове, които са разпънати по металната повърхност..
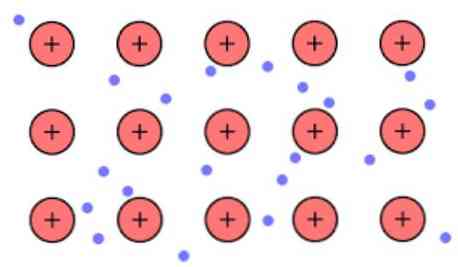
Също така, електроните запазват някакво местоположение в метала, въпреки че вероятностното разпределение на електронния облак има по-висока плътност около някои специфични атоми. Това се дължи на факта, че при прилагане на определен ток те показват тяхната проводимост в определена посока.
индекс
- 1 Основи на теорията за морето от електрони
- 2 Свойства
- 2.1 Отместване във формата на слоеве
- 2.2 Теория на морето от електрони в метални кристали
- 3 Недостатъци на теорията
- 4 Препратки
Основи на теорията за морето от електрони
Металните елементи имат голяма склонност да даряват електрони от последното си енергийно ниво (валентен слой), поради тяхната йонизационна енергия толкова ниска спрямо другите елементи..
Знаейки това, всеки метален елемент може да се разглежда като катион, свързан с електрона на последното му енергийно ниво, което би било по-склонно да дарява..
Тъй като в един метал имате голям брой атоми, които са свързани помежду си, можете да приемете, че този метал образува група метални катиони, които са потопени в някакво море от валентни електрони, които имат голямо офшоринг.
Като се има предвид, че електростатичните сили на привличане, които съществуват между катиона (положителния заряд) и електрона (отрицателния заряд) имат силно свързани метални атоми, той си представя делокализацията на валентните електрони като електростатично лепило, което поддържа връзката към металните катиони.
По този начин може да се заключи, че колкото по-голям е броят на електроните в валентния слой на метал, този вид електростатично лепило ще има по-голяма якост..
свойства
Теорията за морето от електрони предлага просто обяснение за характеристиките на металните видове като устойчивост, проводимост, пластичност и ковъстност, които варират от един метал до друг..
Открито е, че устойчивостта на металите се дължи на голямата делокализация на техните електрони, която генерира много висока кохезионна сила между атомите, които я образуват..
По този начин, пластичността е известна като способността на определени материали да позволят деформацията на тяхната структура, без да дават достатъчно, за да се счупят, когато са подложени на определени сили.
Offshoring под формата на слоеве
Както пластичността, така и пластичността на метал се определят от факта, че валентните електрони са делокализирани във всички посоки под формата на слоеве, което ги кара да се движат един върху друг под действието на външна сила, избягване на счупването на металната конструкция, но позволяващо деформацията му.
По същия начин свободата на движение на делокализираните електрони позволява да има поток от електрически ток, което прави металите много добра проводимост на електроенергията..
В допълнение, това явление на свободно движение на електрони позволява прехвърлянето на кинетична енергия между различните области на метала, което насърчава предаването на топлина и кара металите да проявяват висока топлопроводимост..
Теория на морето от електрони в метални кристали
Кристалите са твърди вещества, които имат физични и химични свойства - като плътност, точка на топене и твърдост - които се установяват от вида на силите, които правят частиците, които ги карат да останат заедно.
В известен смисъл се счита, че кристалите от метален тип имат най-простите структури, тъй като всяка "точка" на кристалната мрежа е заета от атом на самия метал..
В същия смисъл е установено, че структурата на металните кристали е кубична и се фокусира върху лицата или тялото..
Въпреки това, тези видове могат също да бъдат шестоъгълни по форма и да имат сравнително компактно уплътнение, което им дава, че огромната плътност, която е характерна.
Поради тази структурна причина, връзките, които се образуват в металните кристали, са различни от тези, които се срещат в другите видове кристали. Електроните, които могат да образуват връзки, са делокализирани в цялата кристална структура, както е обяснено по-горе.
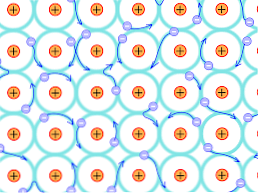
Недостатъци на теорията
В металните атоми има малко количество валентни електрони, пропорционално на техните енергийни нива; това означава, че има по-голямо количество налични енергийни състояния, отколкото количеството на свързаните електрони.
Това означава, че тъй като има силна електронна делокализация и също така енергийни ленти, които са частично запълнени, електроните могат да се движат през ретикуларната структура, когато са подложени на електрическо поле, идващо отвън, в допълнение към образуването на океана от електрони който поддържа пропускливостта на мрежата.
Така обединението на металите се интерпретира като конгломерат от положително заредени йони, свързани с море от електрони (отрицателно заредени).
Въпреки това, съществуват характеристики, които не се обясняват с този модел, като например образуването на някои сплави между метали със специфични състави или стабилността на колективните метални връзки, между другото..
Тези недостатъци се обясняват с квантовата механика, тъй като и тази теория и много други подходи са установени въз основа на най-простия модел на един електрон, докато се опитват да прилагат много по-сложни структури на мулти-електронните атоми..
препратки
- Wikipedia. (2018). Wikipedia. Изтеглено от en.wikipedia.org
- Holman, J.S., and Stone, P. (2001). Химия. Получено от books.google.co.ve
- Parkin, G. (2010). Лепене на метал-метал. Получено от books.google.co.ve
- Rohrer, G. S. (2001). Структура и свързване в кристални материали. Получено от books.google.co.ve
- Ibach, H., и Lüth, H. (2009). Физика на твърдото тяло: Въведение в принципите на материалознанието. Получено от books.google.co.ve


