Характеристики на въглеродния атом, структура, хибридизация, класификация
на въглероден атом Това е може би най-важното и емблематично за всички елементи, защото благодарение на него е възможно съществуването на живота. Тя обгражда сама по себе си не само няколко електрона, или ядро с протони и неутрони, но също и звезден прах, който завършва и образува живи същества..
Също така, въглеродните атоми се намират в земната кора, въпреки че не са с изобилие, сравнимо с метални елементи като желязо, карбонати, въглероден диоксид, масло, диаманти, въглехидрати и т.н. неговите физически и химични прояви.
Но как е въглеродният атом? Първата неточна скица е тази, която се наблюдава на изображението по-горе, чиито характеристики са описани в следващия раздел.
Въглеродните атоми пътуват през атмосферата, моретата, недрата, растенията и всички животински видове. Голямото му химическо разнообразие се дължи на високата стабилност на връзките и на начина, по който са подредени в пространството. Така, от една страна, има гладък и смазващ графит; а от друга - диамантът, чиято твърдост надхвърля тази на много материали.
Ако въглеродният атом нямаше качествата, които го характеризират, органичната химия нямаше да съществува напълно. Някои визионери виждат в него новите материали на бъдещето, чрез проектиране и функционализиране на неговите алотропни структури (въглеродни нанотръби, графен, фулерени и др.).
индекс
- 1 Характеристики на въглеродния атом
- 2 Структура
- 3 Хибридизация
- 3.1 sp3
- 3.2 sp2 и sp
- 4 Класификация
- 4.1 Първичен
- 4.2 Вторични
- 4.3 Висше
- 4.4 Кватернер
- 5 Използване
- 5.1 Атомна маса
- 5.2 Въглероден цикъл и живот
- 5.3 13С ЯМР спектроскопия
- 6 Препратки
Характеристики на въглеродния атом
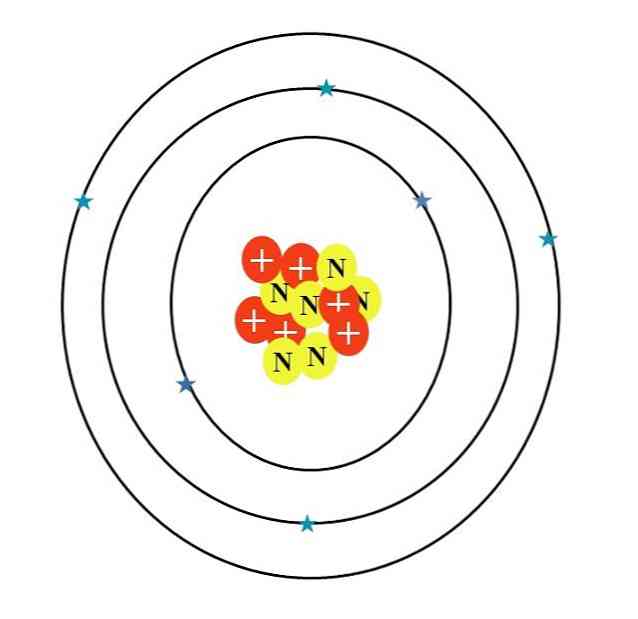
Въглеродният атом е символизиран от буквата C. Атомният му номер Z е 6, следователно има шест протони (червени кръгове със символа "+" в ядрото). Освен това има шест неутрона (жълти кръгове с буквата "N") и накрая шест електрона (сините звезди).
Сумата от масите на техните атомни частици дава средна стойност от 12.0107 u. Въпреки това, атомът в изображението съответства на 12-въглеродния изотоп (12В), който се състои от d. Други изотопи, като 13С и 14C, по-малко изобилие, варират само по броя на неутроните.
Така че, ако нарисувате тези изотопи 13С ще има допълнителен жълт кръг и 14С, още две. Това логично означава, че те са по-тежки въглеродни атоми.
В допълнение към това, какви други характеристики могат да бъдат споменати в това отношение? Той е четиривалентен, т.е. може да образува четири ковалентни връзки. Той е разположен в група 14 (ДДС) на периодичната таблица, по-специално в блок p.
Той също е многостранен атом, способен да се свърже с почти всички елементи на периодичната таблица; особено със себе си, образувайки макромолекули и линейни, разклонени и ламелни полимери.
структура
Каква е структурата на въглеродния атом? За да отговорите на този въпрос, първо трябва да отидете в електронната си конфигурация: 1s22s22P2 или [He] 2s22P2.
Следователно има три орбитали: 1s2, 2s2 и 2р2, всеки с по два електрона. Това може да се види и на изображението по-горе: три пръстена с два електрона (сини звезди) всеки (не бъркайте пръстените с орбити: те са орбитални).
Имайте предвид обаче, че две от звездите имат по-тъмен син цвят от останалите четири. Защо? Тъй като първите две съответстват на вътрешния слой 1s2 или [Той], който не участва директно във формирането на химически връзки; докато електроните във външния слой, 2s и 2p, правят.
S и р орбиталите нямат еднаква форма, така че илюстрираният атом не е в съответствие с действителността; в допълнение към голямата диспропорция на разстоянието между електроните и ядрото, което трябва да бъде стотици пъти по-голямо.
Следователно, структурата на въглеродния атом се състои от три орбитали, където електроните "се топи" в дифузни електронни облаци. А между ядрото и тези електрони има разстояние, което ни позволява да видим огромната "пустота" вътре в атома.
хибридизация
По-рано беше споменато, че въглеродният атом е четиривалентен. Според неговата електронна конфигурация, нейните 2s електрони са сдвоени и 2p електроните са несдвоени:
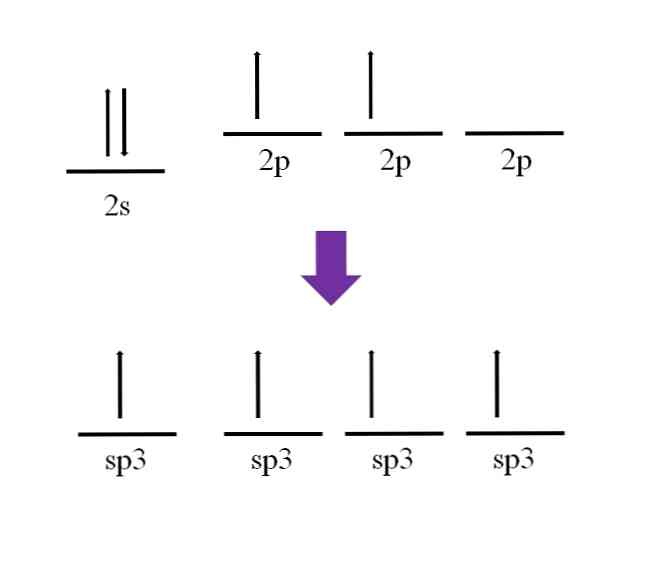
Остава налична р орбитала, която е празна и запълнена с допълнителен електрон в азотния атом (2р3).
Според дефиницията на ковалентната връзка е необходимо всеки атом да допринася с един електрон за неговото образуване; Въпреки това, може да се види, че в базално състояние от въглеродния атом, той едва има два несдвоени електрона (по един във всяка 2р орбитала). Това означава, че в това състояние той е двувалентен атом и следователно образува само две връзки (-C-)..
И така, как е възможно въглеродният атом да образува четири връзки? За да направите това, трябва да популяризирате електрон от орбитата 2s към орбиталната 2p по-висока енергия. Това е направено, че четирите произтичащи орбитали са дегенерат; с други думи, те имат еднаква енергия или стабилност (имайте предвид, че те са подравнени).
Този процес е известен като хибридизация и благодарение на него, сега въглеродният атом има четири орбитални sp3 с по един електрон, за да образуват четири връзки. Това се дължи на неговата характеристика, че е четиривалентен.
SP3
Когато въглеродният атом притежава sp хибридизация3, Ориентирайте четирите му хибридни орбитали към върховете на тетраедър, който е неговата електронна геометрия.
Така че, можете да идентифицирате въглероден sp3 защото образува само четири прости връзки, както в метановата молекула (СН4). И около това може да се наблюдава тетраедрична среда.
Припокриването на sp орбиталите3 той е толкова ефективен и стабилен, че обикновената С-С връзка има енталпия от 345.6 kJ / mol. Това обяснява защо има безкрайни въглеродни структури и неизмерим брой органични съединения. В допълнение към това, въглеродните атоми могат да образуват други видове връзки.
SP2 и sp
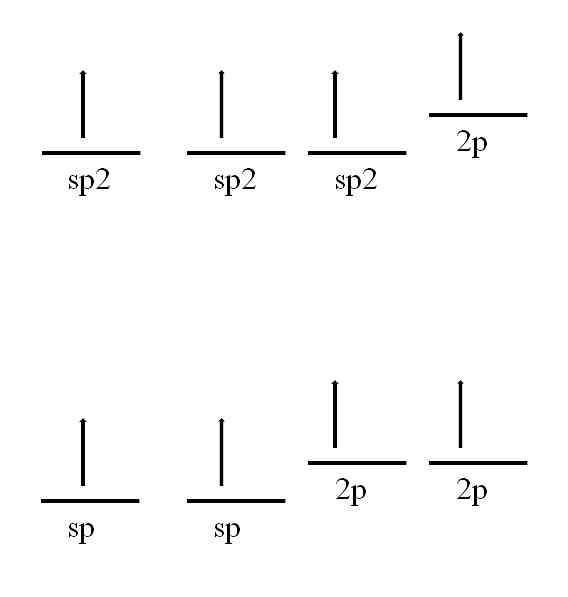
Въглеродният атом също е способен да приема други хибридизации, които ще му позволят да образува двойна или дори тройна връзка.
В sp хибридизация2, Както се вижда на изображението, има три SP орбитали2 дегенерирана и 2р орбитала остава непроменена или "чиста". С трите SP орбитали2 разделени на 120 °, въглеродът образува три ковалентни връзки чрез изтегляне на тригонална електронна геометрия; докато с 2р орбитала, перпендикулярна на останалите три, тя образува връзка π: -C = C-.
За случая на sp хибридизация има две sp орбитали, разделени на 180 °, така че те изготвят линейна електронна геометрия. Този път те имат две чисти 2р орбитали, перпендикулярни един на друг, които позволяват на въглерода да образува тройни връзки или две двойни връзки: -C-C- или ·· C = C = C ·· (централният въглерод има sp хибридизация) ).
Имайте предвид, че винаги (обикновено), ако добавите връзките около въглерода, ще откриете, че числото е равно на четири. Тази информация е от съществено значение при извличането на структурите на Lewis или молекулярните структури. Въглеродният атом, образуващ пет връзки (= C = C), е теоретично и експериментално недопустим.
класификация
Как са класифицирани въглеродните атоми? Повече от класификация по вътрешни характеристики, тя в действителност зависи от молекулярната среда. Това означава, че в молекулата нейните въглеродни атоми могат да бъдат класифицирани според следното.
първичен
Първичен въглерод е този, който е свързан само с друг въглерод. Например, молекулата етан, СН3-СН3 Състои се от два свързани въглерода. Това сигнализира за края или началото на въглеродната верига.
вторичен
Той е свързан с два въглерода. Така че, за молекулата на пропана, СН3-СН2-СН3, въглеродният атом на средата е вторичен (метиленовата група, -СН2-).
третичен
Третичните въглени се различават от останалите, тъй като от тях се появяват клони на основната верига. Например, 2-метилбутан (наричан също изопентан), СН3-СН(СН3) -CH2-СН3 Той има третичен въглерод, подчертан с удебелен шрифт.
четворен
И накрая, четвъртичните въглени, както подсказва името, са свързани с четири други въглеродни атома. Молекулата на неопентан, C(СН3)4 Терминът "алкил" има четвъртичен въглероден атом.
приложения
Атомна маса
Средната атомна маса на 12С се използва като стандартна мярка за изчисляване на масите на другите елементи. По този начин, водородът тежи дванадесета от този въглероден изотоп, който се използва за определяне на това, което е известно като атомна маса u.
По този начин другите атомни маси могат да бъдат сравнени с тези на 12C и 1H. Например, магнезий (24Mg) тежи около два пъти повече от въглероден атом и 24 пъти повече от водороден атом.
Въглероден цикъл и живот
Растенията абсорбират СО2 в процеса на фотосинтеза, за да освободи кислород в атмосферата и да действа като белодробни растения. Когато умрат, те стават въглен, който след изгаряне освобождава CO2. Една част се връща към растенията, но друга се озовава в морските дъна, подхранвайки много микроорганизми.
Когато микроорганизмите умират, оставащото твърдо вещество до неговите биологични седименти на разграждане, и след милиони години, то се превръща в така нареченото масло.
Когато човечеството използва това масло като алтернативен източник на енергия за изгарянето на въглища, то допринася за освобождаването на повече CO2 (и други нежелани газове).
От друга страна, животът използва въглеродните атоми от най-дълбоката му основа. Това се дължи на стабилността на нейните връзки, което му позволява да образува вериги и молекулярни структури, които образуват макромолекули, толкова важни, колкото и ДНК.
ЯМР спектроскопия 13C
на 13C, въпреки че е в много по-малка част от тази на 12С, неговото изобилие е достатъчно, за да се изяснят молекулярните структури чрез въглеродна-13 ядрено-магнитна резонансна спектроскопия.
Благодарение на тази техника за анализ може да се определи кои атоми обграждат 13C и към кои функционални групи принадлежат. По този начин може да се определи въглеродният скелет на всяко органично съединение.
препратки
- Греъм Соломонс T.W., Крейг Б. Фрайле. Органична химия. Амини. (10-то издание.) Wiley Plus.
- Блейк Д. (4 май, 2018 г.). Четири характеристики на въглерода. Изтеглено от: sciencing.com
- Кралско химическо дружество. (2018). Carbon. Взето от: rsc.org
- Разбиране на еволюцията. (Н.О.). Пътуване на въглероден атом. Изтеглено от: evolution.berkeley.edu
- Енциклопедия Британика. (14 март, 2018 г.). Carbon. Изтеглено от: britannica.com
- Pappas S. (29 септември 2017 г.). Факти за въглерода. Взето от: livescience.com


