Структура, свойства, номенклатура и употреби на борен оксид (B2O3)
на борен оксид или борният анхидрид е неорганично съединение, чиято химична формула е В2О3. Тъй като борните и кислородните елементи на p-блока на периодичната таблица и дори повече глави на съответните им групи, разликата между електронегативността между тях не е много висока; следователно може да се очаква, че Б2О3 да бъдат ковалентни по природа.
Б2О3 приготвя се чрез разтваряне на боракс в концентрирана сярна киселина в топилна пещ и при температура от 750 ° С; термична дехидратация на борна киселина, В (ОН)3, при температура от около 300 ° С; или може също така да се образува като продукт от реакцията на диборан (В2Н6) с кислород.

Бор оксид може да има полупрозрачен стъкловиден или кристален вид; Последното може да бъде получено чрез смилане под формата на прах (отгоре изображение).
Макар да не изглежда на пръв поглед, тя се счита за В2О3 като един от най-сложните неорганични оксиди; не само от структурна гледна точка, но и поради променливите свойства, които стъклата и керамиката придобиват, към които те се добавят към тяхната матрица.
индекс
- 1 Структура на борния оксид
- 1.1 Блок BO3
- 1.2 Кристална структура
- 1.3 Структура на стъклото
- 2 Свойства
- 2.1 Физически вид
- 2.2 Молекулна маса
- 2.3 Вкус
- 2.4 Плътност
- 2.5 Точка на топене
- 2.6 Точка на кипене
- 2.7 Стабилност
- 3 Номенклатура
- 4 Използване
- 4.1. Синтез на борни трихалиди
- 4.2 Инсектицид
- 4.3 Разтворител на метални оксиди: образуване на стъкла, керамика и борни сплави
- 4.4 Свързващо вещество
- 5 Препратки
Структура на борния оксид
BO единица3
Б2О3 е ковалентно твърдо вещество, така че на теория в неговата структура няма В-йони3+ нито О2-, но B-O връзки. Бор, съгласно теорията на валентните връзки (ВТЕ), може да образува само три ковалентни връзки; в този случай, три B-O връзки. Като следствие от това, очакваната геометрия трябва да бъде тригонална, BO3.
Молекулата на BO3 дефицит на електрони, особено на кислородни атоми; Въпреки това, някои от тях могат да взаимодействат помежду си, за да доставят споменатия дефицит. Така че, триъгълниците BO3 те се присъединяват чрез споделяне на кислороден мост и се разпределят в пространството като триъгълни редови мрежи, чиито равнини са ориентирани по различни начини.
Кристална структура
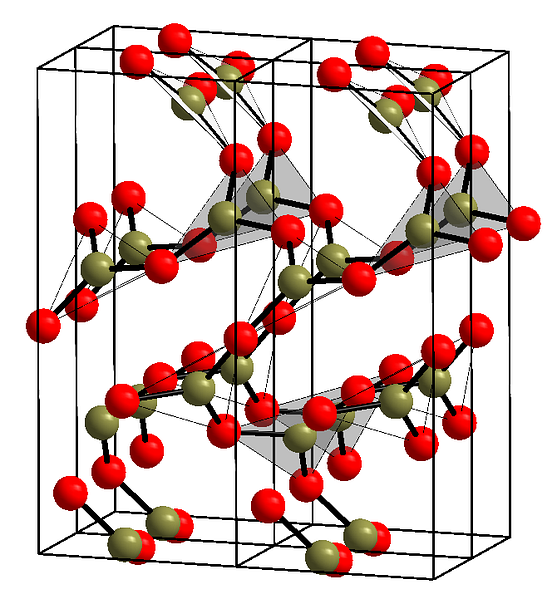
Горното изображение показва пример на споменатите редове с триъгълни единици BO3. Ако се вгледате внимателно, не всички лица на равнините сочат към читателя, а на друга страна. Ориентациите на тези лица могат да бъдат отговорни за това как се дефинира В2О3 при определена температура и налягане.
Когато тези мрежи имат структурен модел на далечни разстояния, това е кристално твърдо вещество, което може да се конструира от своята единична клетка. Тук се казва, че Б2О3 Той има два кристални полиморфа: α и β.
А-В2О3 протича при налягане на околната среда (1 atm) и се казва, че е кинетично нестабилна; всъщност, това е една от причините, поради които борният оксид е вероятно съединение с трудна кристализация.
Другият полиморф, р-В2О3, той се получава при високи налягания в границите на GPa; следователно неговата плътност трябва да бъде по-голяма от плътността на α-B2О3.
Стъклена структура
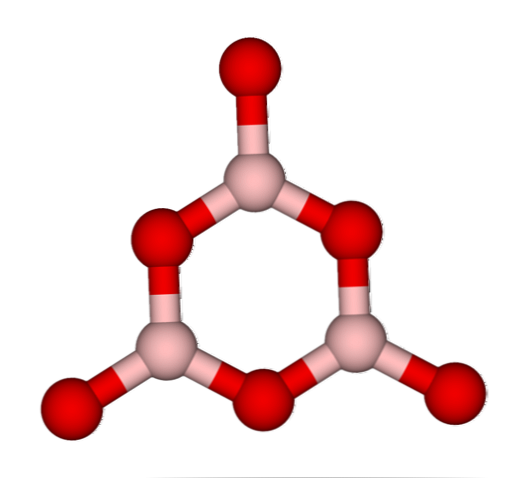
Мрежите BO3 естествено те са склонни да приемат аморфни структури; те са, които нямат модел, който описва молекулите или йони в твърдото вещество. Чрез синтезиране на B2О3 неговата преобладаваща форма е аморфна, а не кристална; с правилни думи: тя е твърдо тяло, по-стъкловидно, отколкото кристално.
Тогава се казва, че Б2О3 той е стъкловидно или аморфен, когато е неговата BO мрежа3 Те са объркани. Не само това, но и те променят начина, по който се събират. Вместо да бъдат подредени в тригонална геометрия, те в крайна сметка са свързани, за да създадат това, което изследователите наричат бороксолов пръстен (отгоре изображение).
Обърнете внимание на очевидната разлика между триъгълни и шестоъгълни единици. Триъгълните характеризират Б2О3 кристален и хексагонален към В2О3 стъкловидното тяло. Друг начин за посочване на тази аморфна фаза е борно стъкло или по формула: g-B2О3 ("g" идва от думата glassy, на английски).
По този начин мрежите на Г-Б2О3 те са съставени от бороксолови пръстени, а не от BO единици3. Обаче, g-B2О3 може да кристализира до а-В2О3, което би означавало взаимно превръщане на пръстени в триъгълници и също така определя степента на кристализация.
свойства
Физически вид
Тя е безцветна и стъклена. В кристалната си форма тя е бяла.
Молекулна маса
69,6182 g / mol.
вкус
Леко горчив
плътност
-Кристално: 2.46 g / mL.
-Стъклено стъкло: 1.80 g / mL.
Точка на топене
Той няма напълно определена точка на топене, тъй като зависи от това колко е кристално или стъкловидно тяло. Чисто кристалната форма се топи при 450 ° С; но стъкловидната форма се топи в диапазон от температури от 300 до 700 ° С.
Точка на кипене
Отново докладваните стойности не съвпадат с тази стойност. Очевидно течен борен оксид (стопен от неговите кристали или стъкло) кипи при 1860ºC.
стабилност
Трябва да се съхранява на сухо, тъй като абсорбира влагата, за да се трансформира в борна киселина, B (OH)3.
номенклатура
Бороксидът може да бъде посочен по други начини, като:
-Дибороксид (систематична номенклатура).
-Борен оксид (III) (номенклатура на запасите).
-Борен оксид (традиционна номенклатура).
приложения
Някои от употребите на борен оксид са:
Синтез на борни трихалиди
От B2О3 може да се синтезира борен трихалид, BX3 (X = F, Cl и Br). Тези съединения са киселини на Люис и с тях е възможно да се въведат борни атоми към определени молекули, за да се получат други производни с нови свойства..
инсектицид
Твърда смес с борна киселина, В2О3-B (OH)3, представлява формула, която се използва като домашен инсектицид.
Разтворител на метални оксиди: образуване на стъкла, керамика и борни сплави
Течният борен оксид е способен да разтваря метални оксиди. От получената смес, след охлаждане, твърдите вещества се получават от бор и метали.
В зависимост от размера на B2О3 използва се, както и техниката и вида на металния оксид, можете да получите богато разнообразие от чаши (боросиликати), керамика (нитриди и бор карбиди) и сплави (ако се използват само метали).
По принцип стъклото или керамиката придобиват по-голяма сила и сила, както и по-голяма издръжливост. В случай на очила, те се използват за оптични лещи и телескопи, както и за електронни устройства.
папка
При изграждането на стоманоплавилни пещи се използват огнеупорни тухли с магнезиева основа. В тях борен оксид се използва като свързващо вещество, което помага да се поддържат тесни.
препратки
- Shiver & Atkins. (2008 г.). Неорганична химия (Четвърто издание). Mc Graw Hill.
- Wikipedia. (2019). Борен триоксид. Изтеглено от: en.wikipedia.org
- PubChem. (2019). Борен оксид. Възстановен от: pubchem.ncbi.nlm.nih.gov
- Рио Тинто. (2019). Оксид на борикс. 20 Mule Team Borax. Изтеглено от: borax.com
- А. Муханов, О. О. Куракевич и В. Л. Соложенко. (Н.О.). За твърдостта на бор (III) оксид. LPMTMCNRS, Université Paris Nord, Villetaneuse, Франция.
- Хансен Т. (2015). B2О3 (Борния оксид). Изтеглено от: digitalfire.com


