Структура, свойства, номенклатура и приложения на сребърен оксид (Ag2O)
на сребърен оксид е неорганично съединение, чиято химична формула е Ag2О. Силата, която обединява атомите му е изцяло йонна; следователно тя се състои от йонно твърдо вещество, където има съотношение на две катиони+ взаимодействащи електростатично с анион О2-.
Оксидният анион, О2-, то е резултат от взаимодействието на сребърните атоми на повърхността с кислорода на околната среда; подобно на желязото и много други метали. Сребърно парче или бижу, вместо зачервяване и разпадане на ръжда, става черно, характерно за сребърен оксид.

Например, на изображението по-горе можете да видите ръждясалата сребърна чаша. Забележете неговата почернела повърхност, въпреки че все още запазва някакъв орнаментален блясък; Ето защо дори ръждивите сребърни предмети могат да се считат за достатъчно привлекателни за декоративни цели.
Свойствата на сребърен оксид са такива, че те не развалят, на пръв поглед, оригиналната метална повърхност. Образува се при стайна температура чрез прост контакт с кислорода във въздуха; и още по-интересно, може да се разложи при високи температури (над 200 ° C).
Това означава, че ако стъклото на изображението е било задържано и топлината на интензивен пламък е била приложена, тя би възстановила нейния сребрист блясък. Следователно, неговото формиране е термодинамично обратим процес.
Сребърен оксид има и други свойства и, извън неговата проста Ag формула2Или включва сложни структурни организации и богато разнообразие от твърди вещества. Въпреки това, Ag2Или може би до Ag2О3, най-представителният от оксидите на среброто.
индекс
- 1 Структура на сребърен оксид
- 1.1 Промени в броя на Валенсия
- 2 Физични и химични свойства
- 2.1 Молекулно тегло
- 2.2 Външен вид
- 2.3 Плътност
- 2.4 Точка на топене
- 2,5 Kps
- 2.6 Разтворимост
- 2.7 Ковалентен характер
- 2.8 Разлагане
- 3 Номенклатура
- 3.1 Valencias I и III
- 3.2 Систематична номенклатура за сложни сребърни оксиди
- 4 Използване
- 5 Препратки
Структура на сребърен оксид
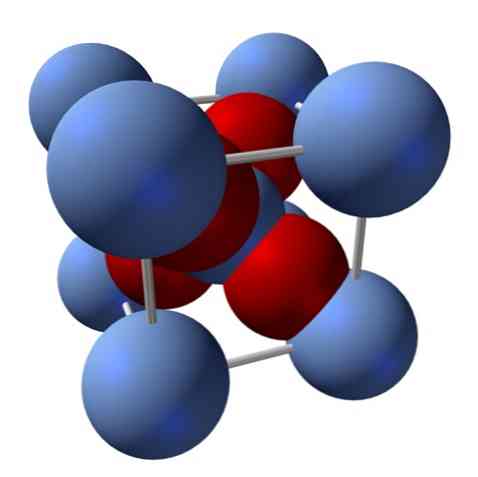
Как е нейната структура? Както бе споменато в началото: тя е йонно твърдо вещество. Поради тази причина не може да има ковалентни връзки Ag - O, нито Ag = O в структурата му; тъй като, ако имаше, свойствата на този оксид биха се променили драстично. Тогава е Аг йони+ и О2- в съотношение 2: 1 и изпитване на електростатично привличане.
Структурата на сребърен оксид се определя вследствие на начина, по който йонните сили изхвърлят в пространството ионите на Ag+ и О2-.
В горното изображение, например, имате единична клетка за кубична кристална система: Ag катиони+ са сребърно сините сфери и О2- червеникавите сфери.
Ако преброите броя на сферите, ще откриете, че на пръв поглед има девет сребристо сини и четири червени цвята. Обаче се вземат под внимание само фрагментите от сферите, съдържащи се в куба; за преброяване на тези, които са части от общите сфери, съотношението 2: 1 за Ag трябва да бъде изпълнено2О.
Повтаряне на структурната единица на тетраедъра на AgO4 заобиколен от четири други Ag+, построено е цялото черно твърдо вещество (премахване на пропуските или нередностите, които тези кристални подредби могат да имат).
Промени с броя на Валенсия
Фокусирайки се сега не върху тетраедъра на AgO4 но в линията AgOAg (наблюдавайте върховете на горния куб), твърдото вещество от сребърен оксид се състои, от друга перспектива, от множество йонни слоеве, разположени линейно (макар и наклонени). Всичко това е резултат от "молекулярната" геометрия около Ag+.
Горното е потвърдено от няколко изследвания на нейната йонна структура.
Среброто работи предимно с валентност +1, тъй като при загуба на електрона електронната му конфигурация е [Kr] 4d10, което е много стабилно. Други валенции, като Ag2+ и Ag3+ те са по-малко стабилни, тъй като губят електрони от орбиталите почти напълно запълнени.
Ag3+, обаче, той е относително по-малко нестабилен в сравнение с Ag2+. Всъщност той може да съществува заедно с Ag+ Химически обогатява структурата.
Електронната му конфигурация е [Kr] 4d8, с несвързани електрони по такъв начин, че му дава известна стабилност.
За разлика от линейните геометрии около йони на Аг+, установено е, че това на Ag-йони3+ Площта е квадратна. Следователно, сребърен оксид с Ag йони3+ ще се състои от слоеве, съставени от AgO квадрати4 (не тетраедри), електростатично свързани чрез AgOAg линии; Такъв е случаят с Ag4О4 или Ag2O. Ag2О3 с моноклинна структура.
Физични и химични свойства

Ако надраскате повърхността на сребърната чаша на основното изображение, ще получите твърдо вещество, което е не само черно, но също така има кафяви или кафяви тонове (отгоре изображение). Някои от неговите физични и химични свойства, описани от моментите, са следните:
Молекулно тегло
231,735 g / mol
вид
Твърда, чернокафява в прахообразна форма (имайте предвид, че въпреки че е йонно твърдо тяло, липсва кристален вид). Той е без мирис и смесен с вода му придава метален вкус
плътност
7,14 g / ml.
Точка на топене
277-300 ° С. Разбира се, той се топи в твърдо сребро; това означава, че вероятно се разгражда преди образуването на течен оксид.
KPS
1.52. 10-8 във вода при 20 ° С. Следователно това е съединение, което е трудно разтворимо във вода.
разтворимост
Ако се вгледате внимателно в образа на неговата структура, ще откриете, че сферите на Ag2+ и О2- Те не са съгласни почти по размер. В резултат на това само малки молекули могат да проникнат във вътрешността на кристалната решетка, което я прави неразтворима в почти всички разтворители; с изключение на тези, в които реагира, като основи и киселини.
Ковалентен характер
Въпреки че многократно е казано, че сребърен оксид е йонно съединение, някои свойства, като неговата ниска точка на топене, противоречат на това твърдение.
Разбира се, разглеждането на ковалентния характер не разрушава обяснението за неговата структура, достатъчно е да го добавим към структурата на Ag \ t2Или модел на сфери и решетки, които показват ковалентни връзки.
Също така, тетраедрите и квадратните равнини AgO4, както и линиите AgOAg, те биха били свързани с ковалентни (или ковалентни йонни) връзки.
Имайки това предвид, Ag2Или всъщност би било полимер. Въпреки това се препоръчва да се разглежда като йонно твърдо вещество с ковалентен характер (чието естество на връзката все още е предизвикателство в днешно време).
разлагане
Отначало се споменава, че образуването му е термодинамично обратимо, така че абсорбира топлината, за да се върне в своето метално състояние. Всичко това може да се изрази чрез две химически уравнения за такива реакции:
4Ag (s) + 02(g) => 2Ag2O (s) + Q
2ag2O (s) + Q => 4Ag (s) + O2(G)
Където Q представлява топлината в уравнението. Това обяснява защо огънят, изгарящ повърхността на ръждясалата сребърна чаша, връща неговия сребрист блясък.
Ето защо е трудно да се предположи, че има Ag2О (l), тъй като ще се разлага незабавно чрез топлина; освен ако налягането е твърде високо, за да се получи споменатата кафява черна течност.
номенклатура
Когато е въведена възможността за Ag йони2+ и Ag3+ освен общата и преобладаваща Ag+, терминът „сребърен оксид“ започва да изглежда недостатъчен, за да се отнася до Ag2О.
Това е така, защото Ag-йонът+ е по-изобилен от другите, така че Аг е взето2Или като единствен оксид; което изобщо не е правилно.
Ако смятате, че Ag2+ като практически несъществуваща, като се има предвид нейната нестабилност, тогава ще присъстват само йони с валенции +1 и +3; т.е. Ag (I) и Ag (III).
Валансиа I и III
Тъй като Ag (I) е най-ниската валентност, тя се нарича чрез добавяне на суфикса -oso към неговото име Argentum. Така че, Ag2Или е: аргентозооксид или, според систематичната номенклатура, дипломатичен монооксид.
Ако Ag (III) е напълно пренебрегнат, неговата традиционна номенклатура трябва да бъде: сребърен оксид вместо аргентински оксид.
От друга страна, Ag (III) е по-голямата валентност, добавя се суфиксът -ico към неговото име. Така че, Ag2О3 е: сребърен оксид (2 Ag йона)3+ с три O2-). Също така наименованието му според систематичната номенклатура ще бъде: диплома триоксид.
Ако се наблюдава структурата на Ag2О3, може да се предположи, че това е продукт на окисляване с озон, OR3, вместо кислород. Следователно, неговият ковалентен характер трябва да бъде по-голям, тъй като е ковалентно съединение с Ag-O-O-O-Ag или Ag-O връзки.3-Ag.
Систематична номенклатура за сложни сребърни оксиди
AgO, също написан като Ag4О4 или Ag2O. Ag2О3, той е сребърен оксид (I, III), тъй като има и двете валенции +1 и +3. Името му според систематичната номенклатура ще бъде: тетра-тетраоксид.
Тази номенклатура е от голяма полза, когато става дума за други стехиометрично по-сложни сребърни оксиди. Например, да предположим двете твърди вещества 2Ag2O. Ag2О3 и Ag2O 3Ag2О3.
Писането на първия по-подходящ начин би било: Ag6О5 (броене и добавяне на атомите на Ag и О). Тогава името му ще бъде хексаплатен пентоксид. Забележете, че този оксид има сребърен състав, по-малко богат от Ag2О (6: 5) < 2:1).
Докато пишете второто твърдо в противен случай, то ще бъде: Ag8О10. Името му ще бъде октаплат decaoxide (с съотношение 8:10 или 4: 5). Този хипотетичен сребърен оксид би бил "много окислен".
приложения
Днес все още се провеждат изследвания в търсене на нови и сложни приложения на сребърен оксид. Някои от неговите употреби са изброени по-долу:
-Той се разтваря в амоняк, амониев нитрат и вода, за да се образува реагентът на Tollens. Този реагент е полезен инструмент в качествените анализи в лабораториите за органична химия. Тя позволява да се определи наличието на алдехиди в проба, като положителният отговор е образуването на "сребърно огледало" в епруветката.
-Заедно с металния цинк той образува първичните батерии от цинков оксид от сребро. Това е може би една от най-често срещаните и домашни приложения.
-Той служи като пречиствател на газ, абсорбиращ например CO2. Когато се затопли, той освобождава задържаните газове и може да се използва няколко пъти.
-Поради антимикробните свойства на среброто, неговият оксид е полезен при проучвания на биоанализа и пречистване на почвата.
-Той е лек окислител, способен да окислява алдехидите до карбоксилни киселини. Използва се също в реакцията на Хофман (третични амини) и участва в други органични реакции, като реагент или катализатор.
препратки
- Bergstresser M. (2018). Сребърен оксид: Формула, разлагане и образуване. Изследване. Изтеглено от: study.com
- Автори и редактори на томове III / 17E-17F-41C. (Н.О.). Сребърни оксиди (Ag (x) O (y)) кристална структура, параметри на решетката. (Числени данни и функционални отношения в науката и технологиите), том 41В. Springer, Берлин, Хайделберг.
- Махендра Кумар Триведи, Рама Мохан Талапрагада, Алис Брантън, Дахрин Триведе, Гопал Наяк, Омпракаш Латиал, Снехасис Жана. (2015). Потенциалното въздействие на енергийното третиране на биополе върху физическите и термичните свойства на праха от сребърен оксид. Международно списание за биомедицински науки и инженерство. Том 3, № 5, с. 62-68. doi: 10.11648 / j.ijbse.20150305.11
- Съливан Р. (2012). Разлагане на сребърен оксид. Университет Орегон Изтеглено от: chemdemos.uoregon.edu
- Флинт, Дейянда. (24 април 2014 г.). Използване на батерии от сребърен оксид. Sciencing. Изтеглено от: sciencing.com
- Salman Montasir E. (2016). Изследване на някои оптични свойства на сребърен оксид (Ag2o) при използване на UV-видим спектрофотометър. [PDF]. Изтеглено от: iosrjournals.org
- Bard Allen J. (1985). Стандартни потенциали във воден разтвор. Марсел Декер. Получено от: books.google.co.ve


