Формула на натриевия оксид (Na2O), свойства, рискове
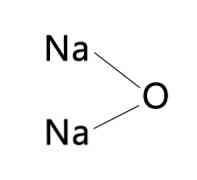
на натриев оксид е неорганично съединение с формула Na2Както всички алкални метални оксиди, той има кристална структура, подобна на антифлуорита (подобно на флуорит, CaF2, но с катиони и инвертирани аниони), която съответства на центрираните повърхности. (Натрий: динатриев оксид, 1993-2016 г.).
Може да се каже, че натриевият оксид е анхидрид на натриев хидроксид, тъй като той реагира с вода за образуване на два мола от това съединение по следния начин:
Na2О + Н2О → 2NaOH
Като цяло, името KNaO може да бъде намерено, отнасяйки се до натриев оксид или калиев оксид. Това е така, защото двата оксида имат подобни свойства по отношение на цвета и скоростта на разширяване и свиване.
Често неразтворимите източници на натриев оксид включват следи от калиев оксид, например в фелдшпати (фигура 2), които са основният източник на натрий в някои емайли (Britt, 2007)..

индекс
- 1 Физични и химични свойства
- 2 Реактивност и опасности
- 3 Използване
- 4 Препратки
Физични и химични свойства
Натриевият оксид е бяло кристално твърдо вещество (фигура 3). Той има молекулно тегло 61,98 g / mol, има плътност 2,27 g / ml и точка на топене 1275 ° C.
Съединението има точка на кипене 1950 ° С, където започва да се разлага до натриев и натриев метален пероксид, но интересен факт е, че натриевият оксид започва да сублимира при 1100 ° С (Национален център за биотехнологична информация, СФ). ).

Реагира бурно с вода и алкохол до образуване на натриев хидроксид. Натриев оксид, Na2Или обратимо абсорбира водород (Н2), за да се образува натриев хидрид (NaH) и натриев хидроксид (NaOH), който има потенциал да намери приложение в обратимото съхранение на водород.
Реактивност и опасности
Натриевият оксид е стабилно незапалимо съединение, но може да реагира бурно с киселини и вода. Той може също така да увеличи изгарянето на други вещества. Той е класифициран като корозивен и може да изгори кожата и очите (Royal Society of Chemistry, 2015).
Разтворът във вода е силна основа, тъй като реагира бурно с корозивни киселини. При бурна реакция с вода се получава натриев хидроксид, който атакува много метали в присъствието на вода.
Веществото също е корозивно за дихателните пътища и поглъщането. Аерозолното вдишване може да предизвика белодробен оток (Национален институт за безопасност и здраве при работа, 2014).
В случай на вдишване, засегнатото лице трябва да се премести на хладно място. Ако жертвата не диша, трябва да се приложи изкуствено дишане. След това отидете или потърсете лекар възможно най-скоро.
В случай на контакт с кожата, замърсените дрехи и обувки трябва да бъдат отстранени незабавно и измити с обилно количество вода.
В случай на контакт с очите, изплакнете обилно с вода в продължение на най-малко 15 минути и се консултирайте с лекар. В случай на поглъщане, не мислете за предизвикване на повръщане, а изплакнете устата си с вода и се консултирайте с лекар.
Най-важните симптоми и ефекти могат да бъдат: спазми, подуване и оток на ларинкса и бронхите, пневмонит, белодробен оток, усещане за парене, кашлица, хрипове, ларингит и затруднено дишане (натриев оксид (Na2O) (cas 1313- 59-3) MSDS, 2010-2017).
Симптомите на белодробен оток често не се проявяват след няколко часа и се влошават от физическо натоварване. Следователно, отдих и медицинско наблюдение са от съществено значение.
Натриевият оксид трябва да се съхранява на сухо място и отделен от силни киселини. Тъй като съединението реагира бурно с вода, в случай на пожар не трябва да се използват пожарогасители на водна основа или пръскачки. Препоръчва се използването на сухи прахове или пясък.
приложения
Основната употреба на натриев оксид е в производството на стъкло. Използва се в керамика и чаши, макар и не в суров вид. Натриевият оксид обикновено съставлява около 15% от химическия състав на стъклото.
Той намалява температурата, при която се стопява силициевият диоксид (състав на стъкло 70%), което води до по-евтино и по-ефективно производство на стъкло, тъй като изисква по-нисък разход на енергия от страна на производителя (George Sumner, sf ).
Натриево-варното стъкло е най-разпространената форма на произведеното стъкло, състояща се от около 70% силициев диоксид (силициев диоксид), 15% сода (натриев оксид) и 9% вар (калциев оксид), с много повече малки от други съединения.
Натриевият оксид служи като поток за понижаване на температурата, при която силициевият диоксид се топи, и варовикът действа като стабилизатор за силициевия диоксид. Натриево-варовата чаша е евтина, химически стабилна, сравнително твърда и изключително работеща, защото може да се омекоти няколко пъти, ако е необходимо.
Тези качества го правят подходящ за производството на широка гама стъклени изделия, включително електрически крушки, чаши, бутилки и предмети от изкуството.
От друга страна, натриевият оксид и силициевият диоксид съдържа воден кристал, наричан още натриев силикат или водно стъкло, който образува стъкловидно тяло с много полезно свойство да бъде разтворимо във вода.
Водното стъкло се продава като твърди бучки или прахове, или като бистра, сиропична течност. Той се използва като удобен източник на натрий за много промишлени продукти като: производител на перилни препарати, като свързващо вещество и лепило, като флокулант в пречиствателни станции и в много други приложения (Enciclopaedia britannica, 2017).
Оксидните съединения не водят до електричество. Въпреки това, някои структурирани пероскитни оксиди са електронни проводници за приложение в катод на твърди оксидни горивни клетки и системи за производство на кислород (American Elements, 1998-2017).
препратки
- Национален институт за безопасност и здраве при работа. (2014, 1 юли). CDC SODIUM OXIDE. Възстановен от cdc.
- Американски елементи. (1998-2017). Натриев оксид. Възстановен от americanelements.com.
- Britt, J. (2007). Пълното ръководство за висок огън. Ню Йорк: Книги за чучулигите.
- Енциклопедия britannica. (2017). Химическо съединение на натриев оксид. Възстановен от britannica.com.
- George Sumner, D.J. (s.f.). Какви са някои от приложенията на натриевия оксид? Възстановен от quora.com.
- Национален център за биотехнологична информация. (S.F.). PubChem Compound Database; CID = 73971. Взето от pubchem.ncbi.nlm.nih.gov.
- Кралско химическо дружество. (2015). Натриев оксид. Извлечено от chemspider.com.
- Ruitao Wang, T. K. (2006). Реакция на водород с натриев оксид: Обратима система за хидрогениране / дехидриране. Journal of Power Sources, том 155, издание 2, 167-171. sciencedirect.com.
- MSDS натриев оксид (Na2O) (cas 1313-59-3). (2010-2017). Изтеглено от guidechem: guidechem.com.
- Натрий: динатриев оксид. (1993-2016). Изтеглено от webelements: webelements.com.


