Характеристики, структура, типове и функции на хистоните
на хистони са основни протеини, които взаимодействат с ДНК за образуване на нуклеозоми, които образуват нишки на хроматин, съставляващи хромозомите в еукариотните организми.
Нуклеозоми, комплекси, образувани от ДНК и протеини, са открити през 1974 г. и именно хистоните събират това базално ниво на хроматиновата организация. Въпреки това, съществуването на хистонови протеини е известно още от 60-те години.
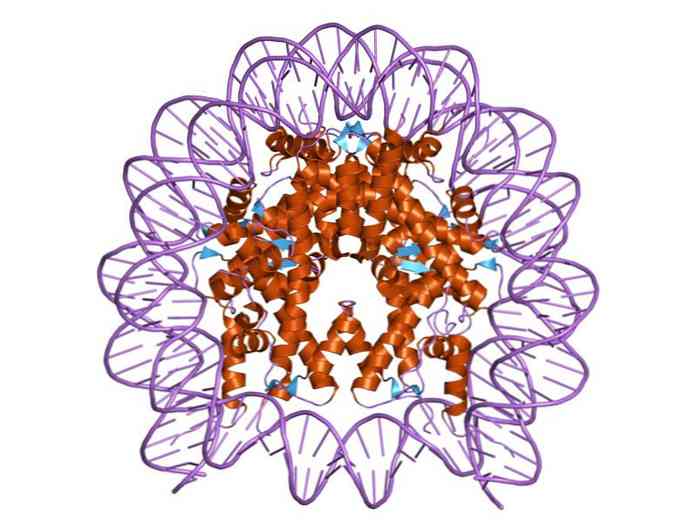
Хистоните са организирани по такъв начин, че ДНК двойната лента е обвита около протеинов център, съставен от тези протеини, които взаимодействат тясно помежду си. Центърът на хистона има форма на диск и ДНК дава около 1,7 оборота около него.
Множество водородни връзки позволяват свързването на ДНК към протеиновия център, образуван от хистоните във всяка нуклеозома. Тези връзки се формират най-вече между аминокиселинните скелети на хистоните и захарния фосфатен гръбнак на ДНК. Някои хидрофобни взаимодействия и йонни връзки също участват.
Протеините, известни като "хроматинови ремоделиращи комплекси", са отговорни за разграждането и образуването на свързващите връзки между ДНК и хистоните, позволявайки влизането на транскрипционния механизъм в ДНК, съдържаща се в нуклеозомите..
Въпреки близостта на нуклеинови киселини към протеиновия център, образуван от хистоните, те са подредени по такъв начин, че ако е необходимо, те позволяват навлизането на транскрипционни фактори и други протеини, свързани с експресията или генетичното заглушаване..
Хистоните могат да претърпят различни модификации, които генерират множество варианти, което прави възможно съществуването на много различни форми на хроматин, които имат свойството да модулират генната експресия по различни начини.
индекс
- 1 Характеристики
- 2 Структура
- 2.1 Хистони на Съюза
- 3 вида
- 3.1 Нуклеозомни хистони
- 3.2 Хистони на Съюза
- 4 Функции
- 5 Препратки
функции
Те са най-запазените еукариотни протеини в природата. Показано е, например, че хистонът на граховото зърно H4 се различава само в две от 102-те аминокиселинни позиции на кравешкия протеин H4..
Хистоните са относително малки протеини, с не повече от 140 аминокиселини. Те са богати на основни аминокиселинни остатъци, така че те имат положителен нетен заряд, който допринася за тяхното взаимодействие с нуклеиновата киселина, отрицателно заредена, за образуване на нуклеозоми..
Известни са нуклеозомни и свързващи или мостови хистони. Нуклеозомните хистони са Н3, Н4, Н2А и Н2В, докато свързващите хистони принадлежат към хистоновото семейство H1.
По време на сглобяването на нуклеозомата първоначално се образуват специфичните димери Н3-Н4 и Н2А-Н2В. След това два H3-H4 димера се свързват, за да образуват тетрамери, които впоследствие се комбинират с димера H2A-H2B, образувайки октамерния център.
Всички хистони се синтезират главно по време на S фазата на клетъчния цикъл, а нуклеозомите се сглобяват в зараждащите се ДНК спирали, точно след вилицата на репликацията..
структура
Общата структура на хистоните включва основна аминокиселинна област и силно запазена глобуларна карбоксилна област сред еукариотните организми..
Структурен мотив, известен като "хистонова гънка", съставен от три алфа спирали, свързани с две вилици и образуващи малък хидрофобен център, е отговорен за взаимодействията на протеин-протеин между хистоните, които образуват нуклеозомата.
Именно това сгъване на хистони съставлява глобуларния карбоксилен домен на споменатите нуклеозомални протеини във всички еукариоти.
Хистоните също имат малки "опашки" или амино-терминални и други карбоксил-крайни участъци (достъпни за протеази) с не повече от 40 аминокиселини по дължина. И двата региона са богати на основни аминокиселини, които могат да претърпят множество пост-транслационни ковалентни модификации.
Хистони на Съюза
В еукариотите има две семейства хистони на обединение, диференцирани по своята структура. Някои имат тристранна структура, като кълбовидната област, описана по-горе, е оградена от N- и С-крайни "неструктурирани" домейни; докато други имат само С-терминален домейн.
Въпреки че повечето хистони са запазени, някои специфични варианти могат да възникнат по време на ембриогенезата или узряването на специализирани клетки в някои организми. Някои структурни вариации са свързани с посттранслационни модификации, като следното:
-фосфорилиране: Смята се, че е свързано с изменението на степента на кондензация на хроматина и обикновено се среща в серинови остатъци.
-ацетилиране: свързани с хромозомни области, които са транскрипционно активни. Той обикновено се появява в страничните вериги на лизиновите остатъци. При появата на тези остатъци положителният заряд намалява, намалявайки афинитета на протеините с ДНК.
-метилиране: може да се даде като моно-, ди- или три-метиламин на лизинови остатъци, стърчащи от протеиновото ядро.
Специфични ензими са отговорни за извършването на тези ковалентни модификации в хистоните. Тези ензими включват хистонови ацетил трансферази (HATs), хистон-деацетилазни комплекси (HDACs) и хистон-метилтрансферази и деметилази..
тип
Характеризирането на хистоните се извършва чрез различни биохимични техники, сред които се открояват хроматографиите, които се основават на слаби катионобменни смоли..
Някои автори установяват метод за класификация, при който 5 основни вида хистони се отличават при еукариотите: FI, с 21 kDa протеини; F2A1 или FIV, плюс или минус 11.3 kDa; F2A2 или FIIbI, 14,5 kDa; F2B или FIIb2, с молекулно тегло от 13,7 kDa, и F3 или FIII, от 15,3 kDa.
Всички тези типове хистони, с изключение на FI групата, се намират в еквимоларни количества в клетките.
Друга класификация, със същата валидност и може би най-използваната в момента, предлага съществуването на два различни типа хистони, а именно: тези, които са част от нуклеозомния октамер и хистоните на свързването или мостовете, които се свързват с нуклеозомите между да.
Някои варианти могат да се появят и между видовете и за разлика от хистоните на ядрото, вариантите се синтезират по време на интерфейса и се вкарват в предварително формирания хроматин чрез процес, зависим от енергията, отделена от хидролизата на АТФ..
Нуклеозомни хистони
Ядрото на нуклеозома се състои от двойка от всяка от четирите съставни хистони: H2a, H2b, Н3 и Н4; върху които се обвиват ДНК сегменти от около 145 базови двойки.
Хистоните Н4 и Н2В по принцип са неизменни. Някои вариации са очевидни, обаче, в хистони Н3 и Н2А, чиито биофизични и биохимични свойства променят нормалната природа на нуклеозома.
Вариант на хистон Н2А при хора, протеинът H2A.Z има голяма киселинна област и може да благоприятства стабилността на нуклеозома в зависимост от варианти на хистон НЗ, с които е свързан.
Тези хистони показват известна вариабилност между видовете, като специален случай на хистон Н2В, за който първата трета от молекулата е силно променлива..
Хистони на Съюза
Хистоните на свързване или мостове са хистони от клас H1. Те са отговорни за обединението между нуклеозомите и защитата на ДНК, която се появява в началото и в края на всяка частица.
За разлика от нуклеозомните хистони, не всички хистони от тип H1 притежават кълбовидната област на "сгъването" на хистоните. Тези протеини се свързват с ДНК между нуклеозомите, като улесняват промяната в баланса на хроматина към по-кондензирано и по-малко активно състояние, транскрипционно.
Изследванията са свързвали тези хистони със стареенето, възстановяването на ДНК и апоптозните процеси, така че се смята, че те имат решаваща роля в поддържането на геномната цялост..
функции
Всички аминокиселинни остатъци от хистони участват, по един или друг начин, във взаимодействието им с ДНК, което обяснява факта, че те са толкова запазени сред царствата на еукариотните организми..
Участието на хистони в опаковката на ДНК под формата на хроматин е от голямо значение за сложните многоклетъчни организми, в които различни клетъчни линии могат да се специализират само чрез промяна на достъпността на гените им до транскрипционния механизъм..
Транскрипционно активните геномни области са плътни в нуклеозомите, което предполага, че свързването на ДНК с хистонови протеини е от решаващо значение за отрицателната или позитивна регулация на тяхната транскрипция..
По същия начин, през целия живот на клетката, отговорът на голям брой стимули, както вътрешни, така и външни, зависи от малки промени в хроматина, които нормално са свързани с посттранслационно ремоделиране и модификация на хистоните, открити в тясна връзка с ДНК.
Няколко хистонови променливи упражняват различни функции в еукариотите. Една от тях е свързана с участието на вариант на хистон Н3 в образуването на центромерни структури, отговорни за сегрегацията на хромозомите по време на митоза.
Показано е, че противодействието на този протеин в други еукариоти е от съществено значение за сглобяването на протеиновия кинетохор, към който се свързват микротубулите на вретеното по време на митоза и мейоза..
препратки
- Alberts, B., Johnson, A., Lewis, J., Morgan, D., Raff, M., Roberts, K., & Walter, P. (2015). Molecular Biology of the Cell (6-то изд.). Ню Йорк: Garland Science.
- Campos, Е. I., & Reinberg, D. (2009). Хистони: Анотиране на хроматин. Annu. Rev. Genet., 43, 559-599.
- Harvey, A.C., & Downs, J.A. (2004). Какви функции осигуряват хистоните на линкер? Molecular Microbiology, 53, 771-775.
- Henikoff, S., & Ahmad, K. (2005). Събиране на варианти на хистони в хроматин. Annu. Cell. Dev. Biol., 21, 133-153.
- Isenberg, I. (1979). Хистони. Annu. Biochem., 48, 159-191.
- Kornberg, R.D., & Thomas, J.O. (1974). Хроматинова структура: олигомери на хистоните. Science, 184 (4139), 865-868.
- Smith, E., DeLange, R., & Bonner, J. (1970). Химия и биология на хистоните. Physiological Reviews, 50 (2), 159-170.


