Бутино структура, свойства и приложения
на бутин е химично съединение, което принадлежи към групата на алкините, характеризиращо се основно с наличието в своята структура поне на тройна връзка между два въглеродни атома..
Когато става въпрос за установяване на правила за наименованието на алкини, IUPAC (акроним на английски за Международния съюз за чиста и приложна химия) е установил, че те се използват същите като за алкени.

Основната разлика между номенклатурата на двата вида вещества е, че суфиксът -од се променя на -или когато става въпрос за съединения, които имат тройни връзки в неговата структура.
От друга страна, butino се състои само от въглерод и водород и се предлага в две форми: 1-бутин, който е в газообразната фаза при стандартни условия на налягане и температура (1 atm, 25 ° C); и 2-бутино, който е течнофазов вид, получен чрез химичен синтез.
индекс
- 1 Химическа структура
- 1.1 1-бутино
- 1.2 2-бутин
- 2 Свойства
- 3 Използване
- 4 Препратки
Химическа структура
В молекулата, известна като butino, е представено явлението структурна изомеризация на позицията, което се състои в наличието на едни и същи функционални групи в двете съединения, но всяка от тях е на различно място от веригата..
В този случай и двете форми на бутино имат идентична молекулна формула; в 1-бутина обаче тройната връзка се намира в въглерод номер едно, а в 2-бутина се намира в номер две. Това ги превръща в изомери на позицията.
Поради местоположението на тройната връзка в един от терминалите на 1-бутиновата структура, тя се разглежда като краен алкин, докато междинното положение на тройната връзка в 2-бутиновата структура му дава класификацията на вътрешния алкин..
Така, връзката може да бъде само между първия и втория въглерод (1-бутин) или между втория и третия въглерод (2-бутин). Това се дължи на прилаганата номенклатура, където най-ниската възможна номерация винаги ще се дава на позицията на тройната облигация.
1-бутин
Съединението, наречено 1-бутин, също е известно като етилацетилен, поради неговата структура и начина, по който неговите четири въглеродни атома са подредени и свързани. Въпреки това, когато говорим за бутин посочва се само този химичен вид.
В тази молекула тройната връзка се намира в крайния въглерод, което позволява наличието на водородни атоми, които му придават голяма реактивност.
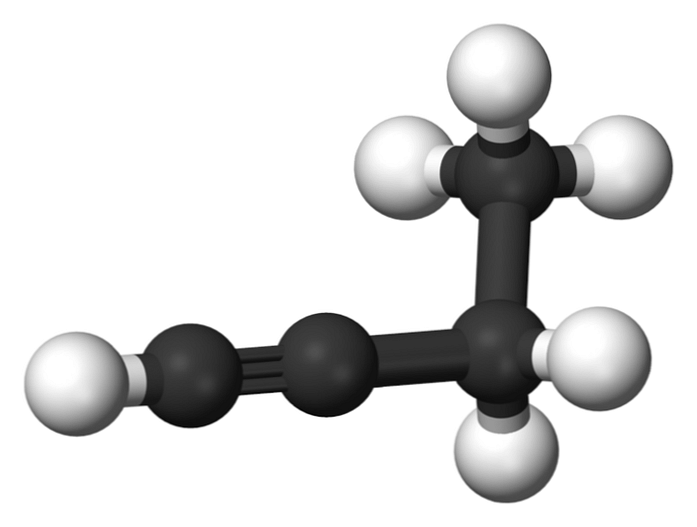
Тази твърда и по-силна връзка от единична или двойна връзка между въглеродните атоми осигурява стабилна конфигурация на 1-бутинова линейна геометрия.
От друга страна, това газообразно вещество е лесно запалимо, така че в присъствието на топлина той може лесно да предизвика пожари или експлозии и да има голяма реактивност в присъствието на въздух или вода..
2-бутин
Тъй като вътрешните алкини показват по-голяма стабилност, отколкото терминалните алкини, те позволяват трансформирането на 1-бутин в 2-бутин.
Тази изомеризация може да настъпи чрез нагряване на 1-бутина в присъствието на основа (като NaOH, KOH, NaOCH3 ...) или чрез пренареждане на 1-бутин в разтвор на калиев хидроксид (КОН) в етанол (С2Н6О).
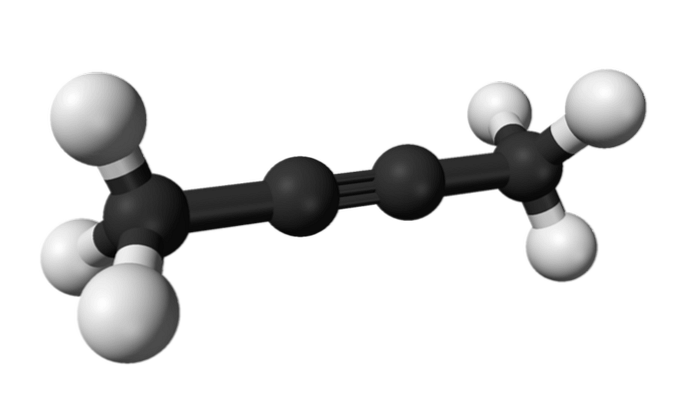
По същия начин химикалът, известен като 2-бутин, се нарича още диметилацетилен (или кротонилен), представящ се като течен и летлив вид, който произхожда изкуствено.
В 2-бутина тройната връзка е в средата на молекулата, което му дава по-голяма стабилност, отколкото неговия изомер.
Освен това, това безцветно съединение има по-ниска плътност от водата, въпреки че се счита за неразтворимо в него и има висока запалимост.
свойства
-Структурната формула на бутино (независимо от кой изомер е посочен) е С4Н6, която има линейна структура.
-Една от химичните реакции, предизвикани от бутиновата молекула, е изомеризация, при която в молекулата се извършва прегрупиране и миграция на тройна връзка..
-1-Butyne е в газова фаза, има много висока запалимост и по-висока плътност от въздуха.
-Тази субстанция също е доста реактивна и в присъствието на топлина може да причини силни експлозии.
-Освен това, когато този безцветен газ претърпи непълна реакция на изгаряне, той може да предизвика въглероден оксид (CO)
-Когато двата изомера са изложени на високи температури, те могат да получат реакции на полимеризация от експлозивен тип.
-2-бутинът е в течна фаза, въпреки че също се счита за доста запалим при стандартни условия на налягане и температура.
-Тези вещества могат да получат силни реакции, когато са в присъствието на силни оксидиращи вещества.
-По същия начин се извършват екзотермични реакции с последващо освобождаване на газообразен водород в присъствието на редуциращи видове..
-Когато са намерени в контакт с определени катализатори (като някои киселинни вещества) или стартерни видове, могат да се появят реакции на полимеризация, екзотермични.
приложения
Тъй като имат различни свойства, двата изомера могат да имат различни приложения и приложения, както е показано по-долу:
На първо място, много често едно от приложенията на 1-бутино е използването му като междинен етап в процеса на производство на други вещества от органичен характер от синтетичен произход..
От друга страна, този химичен вид се използва в преработващата промишленост на каучук и производни съединения; като например, когато искате да получите бензол.
По същия начин, той се използва в производствения процес на голямо разнообразие от пластмасови продукти, както и в производството на много полиетиленови вещества, считани за висока плътност.
Също така, 1-бутинът често се използва като компонент за процесите на рязане и заваряване на някои метални сплави, включително стомана (желязна сплав и въглерод)..
В друг смисъл, 2-бутиновият изомер се използва в комбинация с друг алкин, наречен пропин, в синтеза на някои вещества, известни като алкилирани хидрохинони, когато се извършва процес на тотален синтез на а-токоферол (витамин Е)..
препратки
- Wikipedia. (Н.О.). Бутин. Изтеглено от en.wikipedia.org
- Yoder, C.H., Leber P.A. и Thomsen, M.W. (2010). Мостът към органичната химия: понятия и номенклатура. Получено от books.google.co.ve
- Study.com. (Н.О.). Бутине: Структурна формула и изомери. Получава се от проучване.
- PubChem. (Н.О.). 1-бутин. Взето от pubchem.ncbi.nlm.nih.gov
- PubChem. (Н.О.). 2-бутин. Взето от pubchem.ncbi.nlm.nih.gov


