Структура, свойства, синтез и употреба на циклохексен
на циклохексен е алкен или цикличен олефин, чиято молекулна формула е С6Н10. Състои се от безцветна течност, неразтворима във вода и смесима с много органични разтворители. Характеризира се със запалимост, а в природата обикновено се среща в каменовъглени катрани..
Циклохексен се синтезира чрез частично хидрогениране на бензен и чрез дехидратация на алкохолния циклохексанол; това е по-ръждясала форма. Подобно на други циклоалкени, той претърпява реакции на електрофилно прибавяне и със свободни радикали; например реакцията на халогениране.
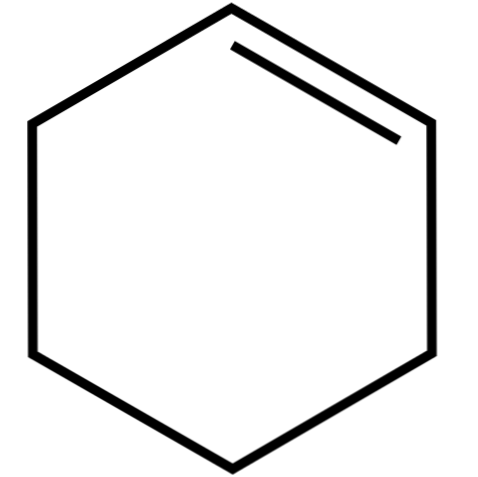
Този цикличен алкен (горен образ) образува азеотропни смеси (които не могат да се отделят чрез дестилация) с по-ниски алкохоли и оцетна киселина. Не е много стабилен при продължително съхранение, тъй като се разлага под въздействието на слънчева светлина и ултравиолетова радиация.
Циклохексенът се използва като разтворител и следователно има множество приложения, като: стабилизатор на високооктанови бензини и за екстракция на масла..
Но най-важното е, че циклохексенът служи като междинен продукт и суровина за производството на много полезни съединения, сред които: циклохексанон, адипинова киселина, малеинова киселина, циклохексан, бутадиен, циклохексилкарбоксилна киселина и др..
индекс
- 1 Структура на циклохексена
- 1.1 Междумолекулни взаимодействия
- 2 Свойства
- 2.1 Химични наименования
- 2.2 Молекулно тегло
- 2.3 Физически вид
- 2.4 Миризма
- 2.5 Точка на кипене
- 2.6 Точка на топене
- 2.7 Точка на запалване
- 2.8 Разтворимост във вода
- 2.9 Разтворимост в органични разтворители
- 2.10 Плътност
- 2.11 Плътност на парите
- 2.12 Налягане на парите
- 2.13 Автоматично запалване
- 2.14 Разлагане
- 2.15 Вискозитет
- 2.16 Топлина на горене
- 2.17 Изпарителна топлина
- 2.18 Повърхностно напрежение
- 2.19 Полимеризация
- 2.20 Праг на мирис
- 2.21 Индекс на пречупване
- 2.22 рН
- 2.23 Стабилност
- 2.24 Реакции
- 3 Резюме
- 4 Използване
- 5 Рискове
- 6 Препратки
Структура на циклохексена
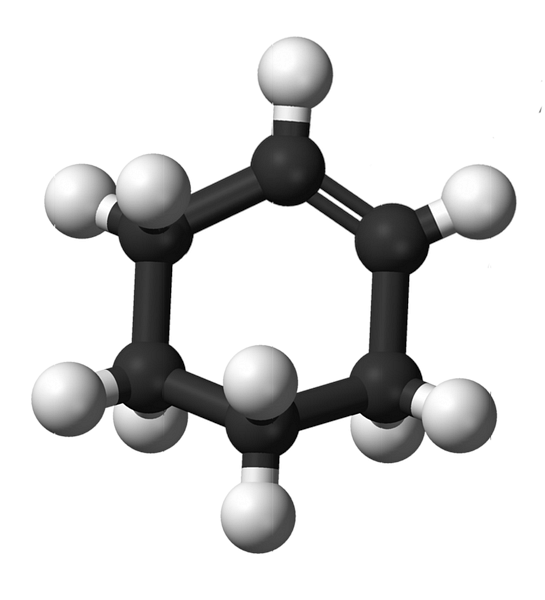
Структурата на циклохексена с модел на сфери и решетки е показана на изображението по-горе. Човек може да забележи шест въглеродния пръстен и двойната връзка, и двете ненаситеност на съединението. От тази гледна точка изглежда, че пръстенът е плосък; но въобще не е така.
Като начало, въглеродите на двойната връзка имат sp хибридизация2, което им дава тригонална геометрия. Следователно тези два въглерода и тези в съседство с тях са в една и съща равнина; докато двата въглерода в противоположния край (към двойната връзка) са над и под посочената равнина.
По-ниското изображение илюстрира идеално това, което току-що беше обяснено.

Забележете, че черната лента е съставена от четири въглерода: двете от двойната връзка и другите съседни на тях. Изложената гледна точка е тази, която ще бъде получена, ако зрителят постави окото си точно пред двойната връзка. Тогава може да се види, че въглеродът е над и под тази равнина.
Тъй като молекулата на циклохексена не е статична, двата въглерода ще се разменят: единият ще се понижи, а другият ще се издигне над равнината. Така че очаквате тази молекула да се държи.
Междумолекулни взаимодействия
Циклохексенът е въглеводород и следователно неговите междумолекулни взаимодействия се основават на дисперсионните сили на Лондон.
Това е така, защото молекулата е неполярна, без постоянен диполен момент и неговото молекулно тегло е факторът, който допринася най-много за поддържането на кохезията в течността..
Също така, двойната връзка увеличава степента на взаимодействие, тъй като тя не може да се движи със същата гъвкавост като тази на другите въглени и това благоприятства взаимодействието между съседните молекули. Поради тази причина циклохексенът има малко по-висока точка на кипене (83 ° C) от циклохексана (81 ° C)..
свойства
Химични наименования
Циклохексен, тетрахидробензен.
Молекулно тегло
82,146 g / mol.
Физически вид
Безцветна течност.
миризма
Сладка миризма.
Точка на кипене
83 ° С до 760 mmHg.
Точка на топене
-103,5 ° С.
Точка на запалване
-7ºC (затворена чаша).
Разтворимост във вода
На практика неразтворим (213 mg / L).
Разтворимост в органични разтворители
Смесва се с етанол, бензол, въглероден тетрахлорид, петролев етер и ацетон. Очаква се той да може да разтваря неполярните съединения, като някои от алотропите на въглищата.
плътност
0.810 g / cm3 при 20 ° С.
Плътност на парите
2.8 (спрямо въздуха, взет като равен на 1).
Парно налягане
89 mmHg при 25 ° С.
Самозапалване
244 ° С.
разлагане
Разлага се в присъствието на уранови соли под действието на слънчева светлина и ултравиолетова радиация.
вискозитет
0,625 mPascal при 25 ° С.
Топлина на горене
3,751.7 kJ / mol при 25 ° С.
Изпарителна топлина
30,46 kJ / mol при 25 ° С.
Повърхностно напрежение
26,26 mN / m.
полимеризация
Той може да се полимеризира при определени условия.
Праг на мирис
0.6 mg / m3.
Индекс на пречупване
1.4465 при 20 ° С.
рН
7-8 при 20ºC.
стабилност
Циклохексенът не е много стабилен по време на дългосрочно съхранение. Излагането на светлина и въздух може да предизвика производството на пероксиди. По същия начин, той е несъвместим със силни окислителни агенти.
реакции
-Циклоалкените имат предимно реакции на присъединяване, както електрофилни, така и свободни радикали.
-Реагира с бром до образуване на 1,2-дибромоциклохексан.
-Окислява бързо в присъствието на калиев перманганат (KMnO4).
-Той е в състояние да произвежда епоксид (циклохексен оксид) в присъствието на пероксибензоена киселина.
синтез
Циклохексенът се получава чрез киселинен катализ на циклохексанол:
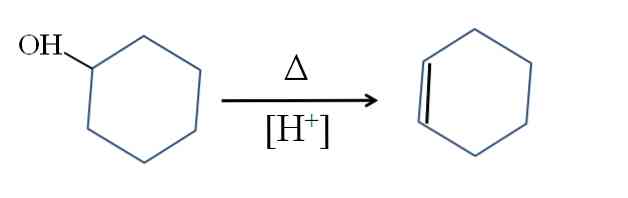
Символът А представлява топлината, необходима за подпомагане на излизането на ОН групата като водна молекула в кисела среда (-ОН2+).
Циклохексенът също се получава чрез частично хидрогениране на бензен; две негови двойни връзки добавят молекула водород:
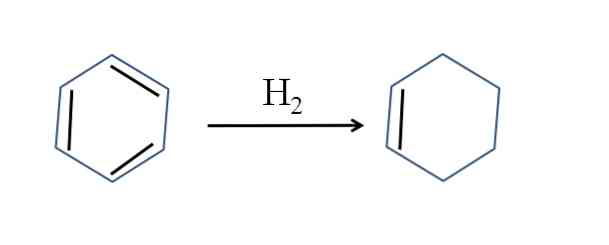
Въпреки че реакцията изглежда проста, тя изисква голямо налягане от Н2 и катализатори.
приложения
-Той е полезен като органичен разтворител. Освен това той е суровина за производството на адипинова киселина, адипичен алдехид, малеинова киселина, циклохексан и циклохексилкарбоксилна киселина..
-Той се използва в производството на циклохексан хлорид, съединение, използвано като посредник при производството на фармацевтични продукти и добавки от каучук..
-Циклохексенът се използва също в синтеза на циклохексанон, суровина за производството на лекарства, пестициди, парфюми и оцветители.
-Циклохексенът участва в синтеза на аминоциклохексанол, съединение, което се използва като повърхностно активно вещество и емулгатор..
-В допълнение, циклохексенът може да се използва за приготвяне в лаборатория на бутадиен. Последното съединение се използва в производството на синтетичен каучук, при производството на гуми за автомобили, и се използва също в производството на акрилни пластмаси.
-Циклохексенът е суровина за синтеза на лизин, фенол, полициклоолефинова смола и каучукови добавки.
-Използва се като стабилизатор на високооктанови бензини.
-Участва в синтеза на водоустойчиви покрития, устойчиви на пукнатини филми и свързващи свързващи вещества за покрития.
рискове
Циклохексенът не е много токсично съединение, но може да причини зачервяване на кожата и очите при контакт. Неговото вдишване може да предизвика кашлица и сънливост. Освен това поглъщането му може да причини сънливост, затруднено дишане и гадене.
Циклохексенът се абсорбира слабо в стомашно-чревния тракт, така че не се очакват сериозни системни ефекти поради приема. Най-голямото усложнение е неговата аспирация от дихателната система, която може да предизвика химическа пневмония.
препратки
- Джоузеф Ф. Чианг и Саймън Харви Бауер. (1968). Молекулна структура на циклохексена. J. Am.Chem.Soc. 1969, 91, 8, 1898-1901.
- Кари Барнс. (2019). Циклохексен: опасности, синтез и структура. Изследване. Изтеглено от: study.com
- Morrison, R.T. and Boyd, R.N. (1987). Органична химия (5та Edition.). Редакционна Аддисън-Уесли Ибероамерикана.
- PubChem. (2019). Циклохексен. Възстановен от: pubchem.ncbi.nlm.nih.gov
- Химическа книга. (2019). Циклохексен. Изтеглено от: chemicalbook.com
- Токсикологична мрежа за данни. (2017). Циклохексен. TOXNET. Извлечено от: toxnet.nlm.nih.gov
- Chemoxy. (Н.О.). Структурната формула за циклохексена е. Получено от: chemoxy.com


