Структура, свойства, образуване, употреба на бромоводородна киселина (НВг)
на Хидробромна киселина е неорганично съединение, което е резултат от водния разтвор на газ, наречен бромоводород. Неговата химична формула е HBr и може да се разглежда по различни начини: като молекулен хидрид, или водороден халогенид във вода; т.е. хидразид.
В химическите уравнения, тя трябва да бъде записана като HBr (ac), за да покаже, че е бромоводородна киселина, а не газ. Тази киселина е една от най-силните известни, дори повече от солната киселина, HCl. Обяснението за това е в естеството на неговата ковалентна връзка.
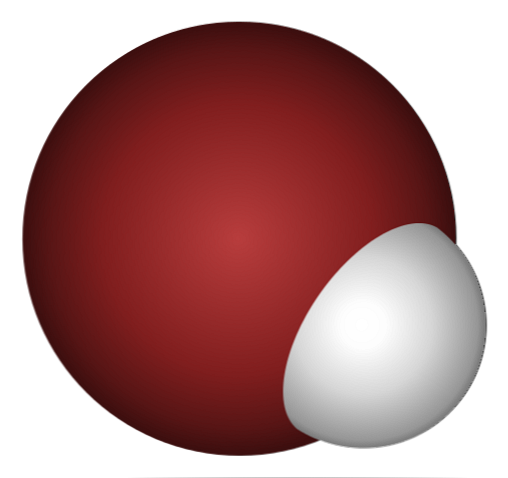
Защо НВг е такава киселина и дори повече се разтваря във вода? Тъй като ковалентната връзка H-Br е много слаба, поради лошото припокриване на 1s орбиталите на H и 4p на Br.
Това не е изненадващо, ако се вгледате внимателно в изображението по-горе, където ясно бромният атом (кафяв) е много по-голям от водородния атом (бял).
Следователно, всяко нарушение причинява разрушаване на H-Br връзката, освобождавайки H-йона+. След това, бромоводородната киселина е киселина на Brönsted, тъй като тя пренася протони или водородни йони. Неговата якост е такава, че се използва в синтеза на няколко органобромирани съединения (като 1-Bromoetane, CH3СН2Br).
Хидробромната киселина е след хидрид HI, един от най-силните и най-полезни хидроциди за смилането на някои твърди проби.
индекс
- 1 Структура на бромоводородна киселина
- 1.1 Киселинност
- 2 Физични и химични свойства
- 2.1 Молекулна формула
- 2.2 Молекулно тегло
- 2.3 Физически вид
- 2.4 Миризма
- 2.5 Праг на мирис
- 2.6 Плътност
- 2.7 Точка на топене
- 2.8 Точка на кипене
- 2.9 Разтворимост във вода
- 2.10 Плътност на парите
- 2.11 pKa киселинност
- 2.12 Калориен капацитет
- 2.13 Стандартна моларна енталпия
- 2.14 Стандартна моларна ентропия
- 2.15 Точка на възпламеняване
- 3 Номенклатура
- 4 Как се формира?
- 4.1 Смес от водород и бром във вода
- 4.2 Фосфорен трибромид
- 4.3 Серен диоксид и бром
- 5 Използване
- 5.1. Получаване на бромиди
- 5.2 Синтез на алкилхалогениди
- 5.3 Катализатор
- 6 Препратки
Структура на бромоводородна киселина
Структурата на H-Br е показана на изображението, чиито свойства и характеристики, дори тези на газа, са тясно свързани с неговите водни разтвори. Ето защо идва момент, в който да попаднете в объркване за това коя от двете съединения се споменава: HBr или HBr (ac).
Структурата на HBr (ac) е различна от тази на HBr, защото сега водните молекули разтварят тази двуатомна молекула. Когато е достатъчно близо, H се прехвърля+ към молекула от Н2Или както е посочено в следното химическо уравнение:
НВг + Н2O => Br-- + Н3О+
Така структурата на бромоводородната киселина се състои от йони на Br-- и Н3О+ взаимодействат електростатично. Сега, това е малко по-различно от ковалентната връзка на H-Br.
Неговата голяма киселинност се дължи на обемистия анион Br- едва взаимодейства с Н3О+, не е в състояние да му попречи да прехвърли H+ на други околни химически видове.
вкисналост
Например, Cl- и F- въпреки че те не образуват ковалентни връзки с Н3О+, те могат да взаимодействат чрез други междумолекулни сили, като водородни мостове (които само F- е в състояние да ги приеме). Водородните мостове F--Н-OH2+ "Пречи на" даряването на Н+.
Поради тази причина флуороводородна киселина, HF, е по-слаба киселина във вода от бромоводородна киселина; тъй като йонните взаимодействия Br- Н3О+ не притеснявайте прехвърлянето на Н+.
Въпреки това, въпреки че водата е налична в HBr (ac), поведението му в края на описанието е подобно на това на молекула H-Br; т.е. H+ Прехвърля се от HBr или Br-Н3О+.
Физични и химични свойства
Молекулна формула
HBr.
Молекулно тегло
80,972 g / mol. Имайте предвид, че както е споменато в предишния раздел, се разглежда само HBr, а не водната молекула. Ако молекулната маса е взета от формулата Br-Н3О+ тя би имала стойност от приблизително 99 g / mol.
Физически вид
Безцветна или бледожълта течност, която ще зависи от концентрацията на разтворен HBr. Колкото по-жълто е, толкова по-концентрирано и опасно ще бъде.
миризма
Арид, дразнещ.
Праг на мирис
6.67 mg / m3.
плътност
1.49 g / cm3 (воден разтвор при 48% w / w). Тази стойност, подобно на тези, съответстващи на точките на топене и кипене, зависи от количеството HBr, разтворено във водата.
Точка на топене
-11 ° C (12 ° F, 393 ° K) (воден разтвор при 49% w / w).
Точка на кипене
122 ° С (252 ° F 393 ° К) при 700 mmHg (воден разтвор 47-49% w / w).
Разтворимост във вода
-221 g / 100 ml (при 0 ° С).
-204 g / 100 ml (15 ° С).
-130 g / 100 ml (100 ºC).
Тези стойности се отнасят за газообразен HBr, а не за бромоводородна киселина. Както може да се види, повишаването на температурата намалява разтворимостта на HBr; поведение, което е естествено в газовете. Следователно, ако се изискват концентрирани HBr (ac) разтвори, е по-добре да се работи с тях при ниски температури.
Ако работи при високи температури, HBr ще избяга под формата на газообразни двуатомни молекули, така че реакторът трябва да бъде запечатан, за да се предотврати изтичане.
Плътност на парите
2.71 (във връзка с въздуха = 1).
Киселинност рКа
-9.0. Тази константа е толкова отрицателна, че е показателна за неговата голяма сила на киселинност.
Калориен капацитет
29,1 kJ / mol.
Стандартна моларна енталпия
198,7 kJ / mol (298 ºK).
Стандартна моларна ентропия
-36,3 kJ / mol.
Точка на запалване
Не е запалим.
номенклатура
Името му „бромоводородна киселина“ съчетава два факта: наличието на вода и бромът има валентност от -1 в съединението. На английски език е малко по-очевидна: бромоводородна киселина, където префиксът „hydro“ (или hydro) се отнася за вода; въпреки че наистина може да се отнася и до водород.
Бромът има валентност от -1, тъй като е свързан с водородния атом по-малко електронегативен, отколкото е; но ако е свързан или взаимодейства с кислородни атоми, той може да има многобройни валенции, като: +2, +3, +5 и +7. С H може да се приеме само една валентност и затова към неговото име се добавя суфиксът -ico.
Докато HBr (g), бромоводород, е безводен; няма вода. Ето защо тя е посочена в съответствие с други стандарти за номенклатура, съответстващи на тези на водородните халогениди.
Как се формира?
Има няколко синтетични метода за приготвяне на бромоводородна киселина. Някои от тях са:
Смес от водород и бром във вода
Без описание на техническите детайли, тази киселина може да бъде получена от директната смес от водород и бром в реактор, напълнен с вода.
Н2 + Br2 => HBr
По този начин, тъй като HBr се образува, той се разтваря във водата; Това може да го завлече в дестилациите, така че разтворите могат да бъдат извлечени с различни концентрации. Водородът е газ, а бромът е тъмночервеникава течност.
Фосфорен трибромид
В по-сложен процес се смесват пясък, хидратиран червен фосфор и бром. Водните капани се поставят в ледени вани, за да се предотврати изтичането на НВг и образуването на бромоводородна киселина. Реакциите са:
2P + 3Br2 => 2PBr3
РВгЗ3 + 3H2О => 3HBr + H3PO3
Серен диоксид и бром
Друг начин за приготвянето му е да реагира бромът със серен диоксид във вода:
Br2 + SW2 + 2H2О => 2HBr + H2SW4
Това е редокс реакция. Br2 намалява, получава електрони чрез свързване с водородите; докато ИВ2 окислява, губи електрони, когато образува повече ковалентни връзки с други кислородни вещества, както в сярната киселина.
приложения
Приготвяне на бромиди
Бромидните соли могат да бъдат получени, ако HBr (ac) реагира с метален хидроксид. Например, производството на калциев бромид се счита за:
Ca (OH)2 + 2HBr => CaBr2 + Н2О
Друг пример е за натриев бромид:
NaOH + HBr => NaBr + H2О
По този начин могат да бъдат получени много от неорганичните бромиди.
Синтез на алкилхалогениди
А какво да кажем за органичните бромиди? Това са органобромирани съединения: RBr или ArBr.
Дехидратация на алкохоли
Суровината за получаването им може да бъде алкохол. Когато се протонират от киселинността на НВг, те образуват вода, която е добра изходяща група, и вместо това е включен обемният атом на Вг, който ще стане ковалентно свързан с въглерода:
ROH + HBr => RBr + H2О
Тази дехидратация се извършва при температури над 100 ° С, за да се улесни разкъсването на R-OH връзката2+.
Добавка към алкени и алкини
Молекулата на НВг може да бъде добавена от неговия воден разтвор към двойната или тройната връзка на алкена или алкина:
R2С = CR2 + HBr => RHC-CRBr
RC≡CR + HBr => RHC = CRBr
Могат да се получат няколко продукта, но при прости условия продуктът първо се образува там, където бромът е свързан с вторичен, третичен или четвъртичен въглерод (правило Марковников).
Тези халиди се намесват в синтеза на други органични съединения и техният обхват на приложение е много обширен. Също така, някои от тях дори могат да бъдат използвани в синтеза или проектирането на нови лекарства.
Ефирен клавидж
От етерите могат да се получат два алкилхалогениди едновременно, като всяка от тях носи една от двете странични вериги R или R 'на първоначалния етер R-O-R'. Случва се нещо подобно на дехидратацията на алкохолите, но механизмът му на реакция е различен.
Реакцията може да бъде схематизирана със следното химическо уравнение:
ROR '+ 2HBr => RBr + R'Br
И водата също се освобождава.
катализатор
Неговата киселинност е такава, че може да се използва като ефективен киселинен катализатор. Вместо добавяне на Br анион- към молекулярната структура, отваря пътя за друга молекула да го направи.
препратки
- Греъм Соломонс T.W., Крейг Б. Фрайле. (2011 г.). Органична химия. Амини. (10тата издание.). Wiley Plus.
- Кери Ф. (2008). Органична химия (Шесто издание). Mc Graw Hill.
- Стивън А. Хардингър. (2017). Илюстриран речник на органичната химия: бромоводородна киселина. Изтеглено от: chem.ucla.edu
- Wikipedia. (2018). Хидробромна киселина. Изтеглено от: en.wikipedia.org
- PubChem. (2018). Хидробромна киселина. Възстановен от: pubchem.ncbi.nlm.nih.gov
- Национален институт за безопасност и хигиена на работното място. (2011 г.). Бромоводород [PDF]. Изтеглено от: insht.es
- PrepChem. (2016 г.). Приготвяне на бромоводородна киселина. Изтеглено от: prepchem.com


