Химическа структура, свойства, приложения на алуминиев хлорид (AlCl3)
на алуминиев хлорид или алуминиев трихлорид (AlCl3) е бинарна сол, образувана от алуминий и хлор. Понякога той се появява като жълт прах, защото представлява примеси, дължащи се на наличието на железен (III) хлорид.
Тя се получава чрез комбиниране на нейните елементи. Алуминият, който има три електрона в последното си енергийно ниво (семейство IIIA), има тенденция да ги произвежда поради металния си характер. Хлорът със седем електрона в последното си енергийно ниво (семейство VIIA) ги придобива, за да завърши своя октет.
Счита се, че връзката, образувана между алуминий и хлор в алуминиевия трихлорид е ковалентна, въпреки че е обединение между метал и неметален.
Има два вида алуминиев хлорид:
- Безводен алуминиев хлорид. АЮЬ3.
- Алуминиев хлорид хексахидрат. АЮЬ3. 6Н2Това съединение може да бъде намерено в твърда или разтворена форма.
индекс
- 1 Химическа структура
- 2 Свойства
- 2.1 Физически
- 2.2 Химични вещества
- 3 Използване
- 4 Рискове: възможни ефекти
- 5 Препоръки
- 6 Препратки
Химическа структура
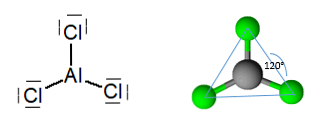
Безводният алуминиев трихлорид е молекула с равнинна тригонална геометрия с ъгъл 120 °, съответстващ на атомна хибридизация.2.
Въпреки това, молекулата е организирана под формата на димери, в която хлорен атом дарява двойка електрони за образуване на връзки. Те са известни като координирани ковалентни връзки.
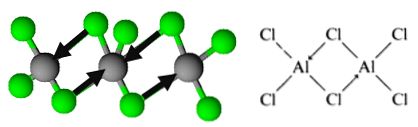
Така се извежда организацията на димерите на алуминиевия трихлорид.
Тази организация позволява на съединението да образува мрежи от димерни слоеве. Когато водата се излива върху твърдия алуминиев трихлорид, те не се дисоциират, както се очаква от йонните съединения, но претърпяват енергична хидролиза..
Напротив, в разредения воден разтвор са координираните йони [Al (H2О)6]+3 и хлорид. Тези структури са много подобни на тези на диборан.
По този начин имате формулата Al2Cl6
Ако се измерва разликата в електроотрицателността на атомите, които образуват връзките в това съединение, може да се наблюдава следното:
За алуминий Al стойността на електроотрицателността е 1,61 ° C, а на хлор - 3,16 ° C. Разликата в електронегативността е 1,55 ° C..
Според правилата на теорията на обвързването, за дадено съединение да е йонно, то трябва да има разлика в електроотрицателността на атомите, които образуват връзката със стойност, по-голяма или равна на 1,7 ° С..
В случая на Al-Cl връзката, разликата в електронегативността е 1.55 ° С, което дава алуминиев трихлорид ковалентна връзка. Тази лека стойност може да се дължи на координираните ковалентни връзки, представени от молекулата.
свойства
физически
вид: бяло твърдо вещество, понякога жълто поради замърсявания, причинени от железен хлорид
плътност2.48 g / mL
Моларна маса133,34 g / mol
сублимация: сублимира при 178 ° С, така че точките му на топене и кипене са много ниски.
шофиране: лошо провежда електричество.
разтворимост: не е разтворим във вода, защото е киселина на Люис. Той е разтворим в органични разтворители като бензен, тетрахлорметан и хлороформ.
химически
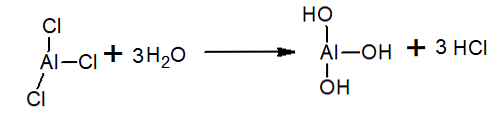
Във водата алуминиевият трихлорид се хидролизира, образувайки НС1 и хидрониевия йон и алуминиевия хидроксид:
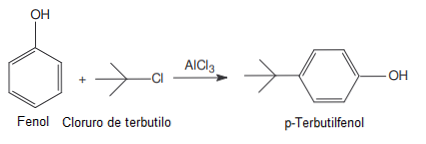
Използва се в реакциите на Фридел-Крафтс като катализатор (вещество, което може да се възстанови в края на реакцията, защото само в него се ускорява, забавя или инициира реакция).
Това е корозивно вещество.
При разлагане, когато реагира бурно с вода, той произвежда алуминиев оксид и опасни газове като хлороводород.
приложения
- антиперспирант.
- Катализатор в ацилиране и алкилиране на Friedel-Crafts.
Рискове: възможни ефекти
- Той е корозивно вещество, причинява изгаряния на кожата и сериозно увреждане на очите.
- Реагира бурно с вода.
- Това е опасно за околната среда.
- Силно токсичен за водни организми.
препоръки
Избягвайте излагането на продукта без необходимите мерки за безопасност. Трябва да се използват, предпазни очила, ръкавици, подходящо облекло, покрита обувка.
В случай на вдишване. Вдишването на прах може да раздразни дихателните пътища поради корозивния характер на веществото. Симптомите включват болки в гърлото, кашлица и задух. Симптомите на белодробен оток могат да бъдат късни и тежките случаи могат да бъдат фатални. Преместете жертвата на просторно място без замърсители. осигурете изкуствено дишане, ако е необходимо. Ако имате затруднено дишане, осигурете кислород. Обадете се на лекаря.
В случай на контакт с кожата. AlCl3 Той е корозивен. Той може да предизвика дразнене или изгаряния при зачервяване и болка. Измийте веднага след контакт с обилно количество вода в продължение на поне 20 минути. Не неутрализирайте и не добавяйте други вещества освен вода. Отстранете замърсеното облекло и го измийте преди повторна употреба. незабавно се консултирайте с лекаря в случай на нараняване.
При контакт с очите. AlCl3 Той е корозивен. Той причинява интензивна болка, замъглено зрение и увреждане на тъканите. Незабавно изплакнете очите с вода в продължение на най-малко 20 минути и дръжте клепачите отворени, за да сте сигурни, че цялото око и тъканите на клепача са изчистени. Промиването на очите за секунди е от съществено значение за постигане на максимална ефективност. Ако имате контактни лещи, отстранете ги след първите 5 минути и след това продължете да изплаквате очите си. Консултирайте се с лекар. Той може да причини сериозно увреждане на роговицата, конюнктивата или други части на окото.
В случай на поглъщане. AlCl3 Той е корозивен. Изгарянето може да причини болка в устата и хранопровода и изгаряния на лигавиците. Той може да предизвика стомашно-чревен дискомфорт при болки в корема, гадене, повръщане и диария. НЕ ПРЕДИЗВИКВАЙТЕ ПОВРЪЩАНЕ. Изплакнете устата и дайте вода за пиене. Никога не давайте нещо устно на човек в безсъзнание. Обадете се на лекаря. Ако се появи спонтанно повръщане, поставете жертвата на неговата или нейната страна, за да намалите риска от аспирация.
Хората със съществуващи кожни заболявания или проблеми с очите или нарушена респираторна функция могат да бъдат по-податливи на въздействието на веществото
Опаковане и съхранение на AlCl съединението3 трябва да се извършва в проветриви, чисти и сухи места.
препратки
- Chemical book, (2017), Алуминиев хлорид. Възстановен от chemicalbook.com
- Космос онлайн, cosmos.com.mx
- Sharpe, A.G., (1993), Органична химия, Испания, Редакционно издание, S.A..
- F., (2017), AlCl алуминиев хлорид3, Insignia. Взети отblog.elinsignia.com.
- TriHealth, (2018), Алуминиев трихлорид, последна актуализация, 4 март, 2018 г., Изтегли от trihealth.adam.com.
- RxWiki, (s.f), Алуминиев хлорид, извлечен от, rxwiki.com.


