Типове молекулярна геометрия и примери
на молекулярна геометрия или молекулярна структура е пространственото разпределение на атомите около централен атом. Атомите представляват региони, където има висока електронна плътност, и следователно се считат за електронни групи, независимо от връзките, които формират (единични, двойни или тройни)..
Тази концепция се ражда от комбинацията и експерименталните данни на две теории: тази на валентната връзка (TEV) и отблъскването на електронните двойки на валентната обвивка (VSPR). Докато първият определя връзките и техните ъгли, вторият определя геометрията и следователно молекулната структура.

Какви геометрични форми са молекули, способни да приемат? Двете предишни теории дават отговорите. Според VSEPR атомите и двойките свободни електрони трябва да бъдат подредени в пространството по такъв начин, че да се сведе до минимум електростатичното отблъскване между тях..
Така че геометричните фигури не са произволни, а търсят най-стабилния дизайн. Например, в горното изображение може да се види триъгълник вляво и октаедър вдясно. Зелените точки представляват атомите и оранжевите ивици на връзките.
В триъгълника трите зелени точки са ориентирани в разстояние от 120º. Този ъгъл, който е равен на този на връзката, позволява на атомите да се отблъскват възможно най-малко. Следователно, молекула с централен атом, прикрепен към три други, ще приеме тригонална геометрия.
Въпреки това, VSCR предсказва, че свободна двойка електрони в централния атом ще наруши геометрията. За случая на тригоналната равнина, тази двойка ще прокара трите зелени точки, което ще доведе до тригонална пирамидална геометрия.
Същото може да се случи и с октаедъра на изображението. В него всички атоми са разделени по възможно най-стабилния начин.
индекс
- 1 Как да знаем предварително молекулната геометрия на атома X?
- 2 вида
- 2.1 Линейно
- 2.2 Ъглови
- 2.3
- 2.4 Trigonal Bipyramid
- 2,5 октаедрични
- 2.6 Други молекулярни геометрии
- 3 Примери
- 3.1 Линейна геометрия
- 3.2 Ъглова геометрия
- 3.3 Тригонален план
- 3.4
- 3.5 Тригонална пирамида
- 3.6 тригонална бипирамида
- 3.7 Колебание
- 3.8 Форма на Т
- 3.9 Октаедрична
- 4 Препратки
Как да знаем предварително молекулната геометрия на атома X?
За тази цел е необходимо да се разгледат и двойките свободни електрони като електронни групи. Те, заедно с атомите, ще определят това, което е известно като електронна геометрия, който е неразделен спътник на молекулярната геометрия.
От електронната геометрия и след като са открити от структурата на Луис двойките свободни електрони, можем да установим каква ще бъде геометрията на молекулата. Сборът от всички молекулярни геометрии ще осигури очертание на глобалната структура.
тип
Както се вижда от основното изображение, молекулярната геометрия зависи от това колко атома заобикалят централния атом. Въпреки това, ако присъства двойка електрони без споделяне, тя ще модифицира геометрията, защото тя заема много обем. Следователно, той упражнява пространствен ефект.
Според това, геометрията може да представи редица характерни форми за много молекули. И тук се появяват различни типове молекулярна геометрия или молекулярна структура.
Кога геометрията е равна на структурата? И двата обозначават същото само в случаите, когато структурата няма повече от един тип геометрия; в противен случай трябва да се имат предвид всички настоящи типове и структурата да се даде глобално име (линейно, разклонено, кълбовидно, плоско и т.н.).
Геометриите са особено полезни, за да обяснят структурата на твърдото тяло от неговите структурни единици.
линеен
Всички ковалентни връзки са насочени, така че връзката А-В е линейна. Но молекулата на АБ ще бъде линейна?2? Ако отговорът е да, геометрията е просто представена като: B-A-B. Двата атома В са разделени с ъгъл от 180 ° и според ТЕВ, А трябва да има sp хибридни орбитали.
ъглов
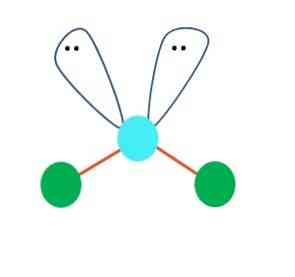
В първия случай може да се приеме линейна геометрия на молекулата АВ2; същевременно е от съществено значение структурата на Люис да се начертае преди да се стигне до заключение. Начертавайки структурата на Люис, може да се идентифицира броят на двойките електрони, без да се споделя (:) върху атома на А.
Когато това е така, на върха на електронните двойки те бутват двата атома на В надолу, променяйки своите ъгли. В резултат линейната молекула B-A-B завършва като V, бумеранг или ъглова геометрия (отгоре изображение)
Водната молекула, H-O-H, е идеалният пример за този тип геометрия. В кислородния атом има две двойки електрони без споделяне, които са ориентирани приблизително под ъгъл от 109 °.
Защо този ъгъл? Тъй като електронната геометрия е четиригранна, която има четири върха: две за Н атоми и две за електрони. На снимката по-горе отбележете, че зелените точки и двата "лопата с очи" рисуват тетраедър със синкавата точка в центъра му.
Ако О няма свободни електронни двойки, водата ще образува линейна молекула, нейната полярност ще намалее, а океаните, моретата, езерата и т.н. вероятно няма да съществуват, както са известни..
тетраедални
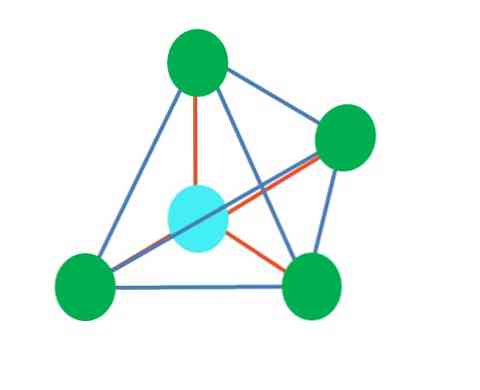
Горното изображение представлява тетраедричната геометрия. За водната молекула електронната й геометрия е четиригранна, но чрез елиминиране на свободните от електрони двойки може да се види, че тя се трансформира в ъглова геометрия. Това се наблюдава и чрез елиминиране на две зелени точки; останалите две ще нарисуват V със синята точка.
Ами ако вместо две двойки свободни електрони имаше само един? Тогава ще има тригонална равнина (главно изображение). Въпреки това, чрез елиминиране на електронна група, пространственият ефект, произведен от двойката свободни електрони, не е избегнат. Следователно тя изкривява тригоналната равнина до триъгълна базова пирамида:

Въпреки че тригоналната и тетраедричната пирамидална молекулярна геометрия са различни, електронната геометрия е същата: тетраедрична. Така тригоналната пирамида не се счита за електронна геометрия?
Отговорът е не, тъй като е продукт на изкривяването, причинено от "лобчето с очите" и неговия стерилен ефект, и тази геометрия не взема предвид по-късните изкривявания.
Поради тази причина винаги е важно първо да се определи електронната геометрия с помощта на структурите на Луис, преди да се определи молекулярната геометрия. Амонячната молекула, NH3, е пример за тригонална пирамидална молекулярна геометрия, но с тетраедрична електронна геометрия.
Тригонална бипирамида
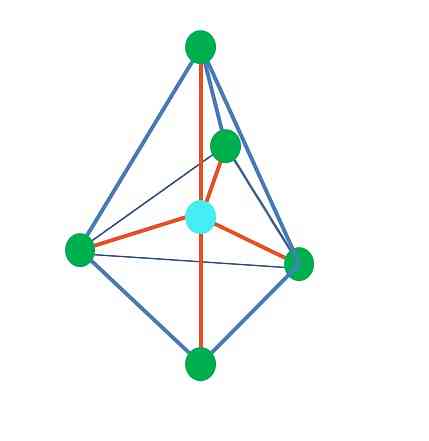
Досега, с изключение на линейната геометрия, в тетраедричната, ъгловата и тригоналната пирамида нейните централни атоми имат sp хибридизация3, според TEV. Това означава, че ако ъглите на връзката са определени експериментално, те трябва да са около 109º.
От тригоналната дипирамидна геометрия има пет електронни групи около централния атом. В горното изображение можете да видите с петте зелени точки; три в триъгълната основа и две в аксиални позиции, които са горните и долните върхове на пирамидата.
Тогава каква хибридизация има синята точка? Необходими са пет хибридни орбитали, за да формират простите връзки (оранжево). Това се постига чрез пет sp орбитали3d (произведение на сместа от орбитален s, три p и a d).
Когато разглеждаме пет електронни групи, геометрията е тази, която вече е изложена, но имаща двойки електрони без споделяне, тази отново страда от изкривявания, които генерират други геометрии. Също така възниква следният въпрос: могат ли тези двойки да заемат някое положение в пирамидата? Те са: аксиален или екваториален.
Аксиални и екваториални положения
Зелените точки, съставляващи триъгълната основа, са в екваториални положения, а двете в горния и долния край, в аксиални положения. Къде, за предпочитане, ще се намира двойката електрони без споделяне? В това положение, което свежда до минимум електростатичното отблъскване и пространствения ефект.
В аксиално положение двойката електрони би „натискала“ перпендикулярно (90 °) върху триъгълната основа, докато ако тя е била в екваториална позиция, двете останали електронни групи на основата биха били на разстояние от 120 ° и натиснете двата края на 90 ° (вместо три, както при базата).
Следователно централният атом ще се стреми да ориентира своите свободни от електрони двойки в екваториалните позиции, за да генерира по-стабилни молекулярни геометрии.
Осцилираща и Т форма
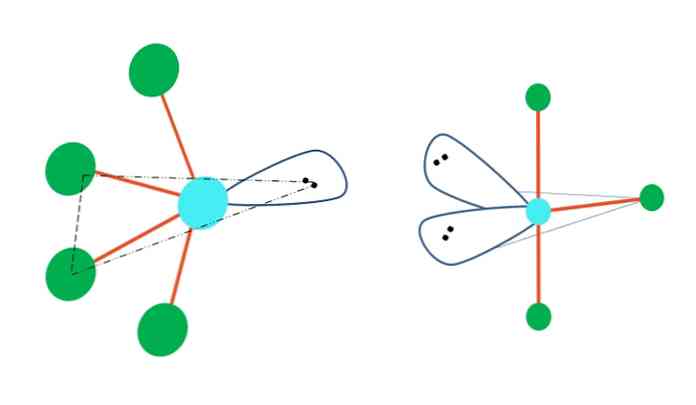
Ако тригоналната бипирамидна геометрия трябваше да замени един или повече от неговите атоми с електрон-свободни двойки, тя също би имала различни молекулярни геометрии.
Вляво от най-горното изображение геометрията се променя в осцилиращата форма. В него свободната двойка електрони избутва останалите четири атома в същата посока, като сгъва връзките си наляво. Забележете, че тази двойка и два от атомите лежат в една и съща триъгълна равнина на оригиналната дипирамида.
И вдясно от изображението, Т-образната геометрия - тази молекулярна геометрия е резултат от подмяната на два атома за две двойки електрони, което води до последващо, че останалите три атома са подравнени в една и съща равнина, която черпи точно една буква. T.
Така че, за молекула от тип AB5, тя приема тригонална бипирамидна геометрия. Въпреки това, AB4, с една и съща електронна геометрия, той ще приеме осцилиращата геометрия; и AB3, Т-образната геометрия Във всички тях А ще има (обикновено) sp хибридизация3г.
За да се определи молекулярната геометрия е необходимо да се начертае структурата на Луис и следователно неговата електронна геометрия. Ако това е тригонална бипирамида, тогава свободните от електрони двойки ще бъдат изхвърлени, но не и техните пространствени ефекти върху останалите атоми. По този начин е възможно да се разграничат идеално между трите възможни молекулярни геометрии.
осмостенен
Октаедричната молекулярна геометрия е представена отдясно на основния образ. Този тип геометрия съответства на АВ съединенията6. AB4 те образуват квадратна основа, а останалите две В са разположени в аксиални положения. По този начин се образуват няколко равностранени триъгълника, които са лицата на октаедъра.
Тук отново могат да съществуват (както във всички електронни геометрии) свободни електронни двойки и следователно други молекулярни геометрии произтичат от този факт. Например, AB5 с октаедрична електронна геометрия се състои от пирамида с квадратна основа и AB4 на квадратна равнина:
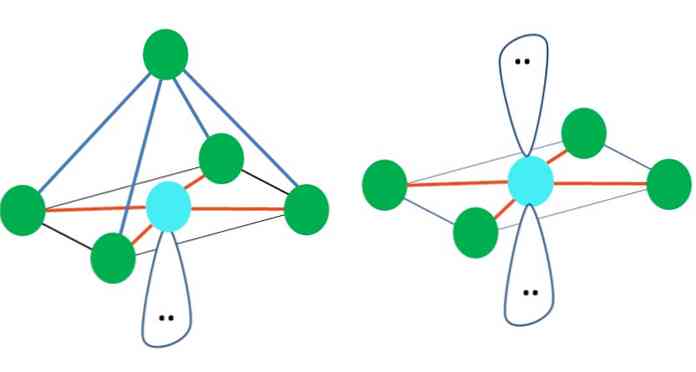
За октаедричната електронна геометрия тези две молекулярни геометрии са най-стабилни от гледна точка на електростатичното отблъскване. В квадратно-равнинна геометрия двете електронни двойки са на 180 °.
Каква е хибридизацията на атома А в тези геометрии (или структури, ако е единствената)? Отново TEV установява, че е sp3г2, шест хибридни орбитали, което позволява на А да ориентира електронните групи във върховете на октаедър.
Други молекулярни геометрии
Чрез модифициране на базите на споменатите досега пирамиди могат да се получат някои по-сложни молекулярни геометрии. Например, петоъгълната бипирамида се основава на петоъгълник и съединенията, които я образуват, имат обща формула А7.
Подобно на другите молекулярни геометрии, заместването на атомите В с електрон-свободни двойки ще наруши геометрията на други форми.
Също така, АВ съединенията8 те могат да възприемат геометрии като квадратен антипризма. Някои геометрии могат да бъдат много сложни, особено за AB формули7 нататък (до AB12).
Примери
След това ще се споменат серии от съединения за всяка от основните молекулни молекули. Като упражнение бихте могли да начертаете структурите на Луис за всички примери и да удостоверите, че с оглед на електронната геометрия ще получите молекулярните геометрии, изброени по-долу..
Линейна геометрия
-Етилен, Н2СН2
-Берилий хлорид, BeCl2 (Cl-Be-CI)
-Въглероден диоксид, CO2 (O = C = O)
-Азот, N2 (N≡N)
-Живачен дибромид, HgBr2 (Br-Hg-Br)
-Анион трийодид, I3- (I-I-I)
-Воден цианид, HCN (H-N ° C)
Неговите ъгли трябва да бъдат 180º и следователно имат sp хибридизация.
Ъглова геометрия
-Водата
-Серен диоксид, SO2
-Азотен диоксид, NO2
-Озон, О3
-Anion amiduro, NH2-
Тригонална равнина
-Бром трифлуорид, BF3
-Алуминиев трихлорид, А1С13
-Нитратен анион, NO3-
-Анион карбонат, СО32-
тетраедални
-Газ метан, СН4
-Въглероден тетрахлорид, CCl4
-Катион амониев, NH4+
-Анион сулфат, SO42-
Тригонална пирамида
-Амоняк, NH3
-Катион хидрониум, Н3О+
Тригонална бипирамида
-Фосфорен пентафлуорид, PF5
-Антимонов пентахлорид, SbF5
вибриращо
Серен тетрафлуорид, SF4
Форма на Т
-Йоден трихлорид, ICl3
-Хлорид трифлуорид, ClF3 (двете съединения са известни като интерхалогени)
осмостенен
-Серен хексафлуорид, SF6
-Селен хексафлуорид, SeF6
-Хексафлуорофосфат, PF6-
За да завърши, молекулярната геометрия е това, което обяснява наблюденията на химичните или физичните свойства на материята. Въпреки това, тя е ориентирана според електронната геометрия, така че тя трябва винаги да се определя преди първата.
препратки
- Уитън, Дейвис, Пек и Стенли. Химия. (8-мо изд.). CENGAGE Learning, стр. 194-198.
- Shiver & Atkins. (2008 г.). Неорганична химия (Четвърто издание., Стр. 23, 24, 80, 169). Mc Graw Hill.
- Mark E. Tuckerman. (2011 г.). Молекулярна геометрия и теория на VSEPR. Изтеглено от: nyu.edu
- Виртуална Chembook, Чарлз Е. Офард. (2003 г.). Въведение в молекулярната геометрия. Изтеглено от: chemistry.elmhurst.edu
- Химия LibreTexts. (8 септември 2016 г.). Геометрия на молекулите. Изтеглено от: chem.libretexts.org


