Законът на Раул, в който се съдържа, положителни и отрицателни отклонения
на Законът на Раул е предложен от френския химик Франсоа-Мари Раулт през 1887 г. и служи за обяснение на поведението на парното налягане на разтвор на две смесими вещества (типично идеални) в зависимост от парциалното налягане на парите на всеки компонент, присъстващ в това.
Има закони на химията, които се използват за описване на поведението на веществата в различни условия и обясняват явленията, в които те участват, използвайки научно доказани математически модели. Законът на Раул е един от тях.

Използвайки обяснение, основаващо се на взаимодействията между молекулите на газовете (или течностите), за да предскаже поведението на наляганията на парите, този закон се използва за изследване на неидеални или реални решения, при условие че се считат необходимите коефициенти за коригиране на модела математически и да го приспособи към неидеални условия.
индекс
- 1 От какво се състои??
- 2 Положителни и отрицателни отклонения
- 2.1 Положителни отклонения
- 2.2 Отрицателни отклонения
- 3 Примери
- 3.1 Основна смес
- 3.2 Бинарна смес с нелетливо разтворено вещество
- 4 Препратки
От какво се състои??
Законът на Раул се основава на предположението, че съответните решения се държат идеално: това се случва, защото този закон се основава на идеята, че междумолекулните сили между различните молекули са същите като тези между подобни молекули (които в действителност не е толкова успешна).
Всъщност, колкото по-близко е решението към идеалността, толкова по-голяма ще е възможността тя да отговаря на предложените от закона характеристики..
Този закон свързва налягането на парите на разтвора с нелетливо разтворено вещество, заявявайки, че той ще бъде равен на парното налягане на това чисто вещество при тази температура, умножено по моларната му фракция. Това се изразява в математически термини за един компонент по следния начин:
Pаз = P °аз . Xаз
В този израз Pаз е равна на парното налягане на компонента i в газовата смес, P °аз е парното налягане на чистия компонент i и Xаз е молната част на компонента i в сместа.
По същия начин, когато имате няколко компонента в разтвор и те са достигнали състояние на равновесие, можете да изчислите общото налягане на парите на разтвора чрез комбиниране на закона на Раул с Далтон:
P = PºАXА + PºBXB + PºCXв...
Също така, в тези разтвори, където присъстват само едно разтворено вещество и разтворител, законът може да бъде формулиран, както е показано по-долу:
PА = (1-XB) x PºА
Положителни и отрицателни отклонения
Разтворите, които могат да бъдат изследвани с този закон, обикновено трябва да се държат идеално, тъй като взаимодействията между техните молекули са малки и позволяват да се приемат същите свойства в цялото решение без изключение..
Въпреки това идеалните решения на практика не съществуват, така че в изчисленията, които представляват междумолекулни взаимодействия, трябва да се включат два коефициента. Това са коефициентът на фугисност и коефициентът на активност.
В този смисъл, отклоненията по отношение на закона на Раул се определят като положителни или отрицателни, в зависимост от резултатите, получени по това време.
Положителни отклонения
Положителни отклонения по отношение на закона на Раулт се появяват, когато налягането на парите на разтвора е по-голямо от това, което е изчислено с закона на Раул..
Това се случва, когато кохезионните сили между подобни молекули са по-големи от същите сили между различните молекули. В този случай и двата компонента се изпаряват по-лесно.
Това отклонение се вижда в кривата на налягането на парите като максимална точка в даден състав, формирайки положителен азеотроп.
Азеотропът е течна смес от две или повече химични съединения, които се държат като образувани от един компонент и които се изпаряват без промяна на състава..
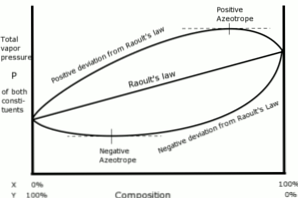
Отрицателни отклонения
Отрицателни отклонения от закона на Раулт възникват, когато налягането на парите на сместа е по-ниско от очакваното след изчисление със закона.
Тези отклонения се появяват, когато кохезионните сили между молекулите на сместа са по-големи от средните на силите между частиците на течностите в тяхното чисто състояние.
Този тип отклонение генерира задържане на всеки компонент в неговото течно състояние чрез атрактивни сили, по-големи от тези на веществото в неговото чисто състояние, така че парциалното налягане на парите на системата се намалява..
Отрицателните азеотропи в кривите на налягането на парите представляват минимална точка и показват афинитет между двете или повече компоненти, включени в сместа.
Примери
Законът на Раулт обикновено се използва за изчисляване на налягането на решение, основаващо се на неговите междумолекулни сили, сравнявайки изчислените стойности с реалните стойности, за да заключим дали има някакво отклонение и дали това трябва да е положително или отрицателно. По-долу са дадени два примера за използване на закона на Раул:
Основна смес
Следната смес, състояща се от пропан и бутан, представлява приближение на налягането на парите и можем да приемем, че и двата компонента са в равни пропорции в него (50-50), при температура 40 ° C:
Xпропан = 0.5
Pºпропан = 1352.1 kPa
Xбутан = 0.5
Pºбутан = 377.6 kPa
Той се изчислява по закона на Раул:
Pсмес = (0.5 х 377.6 kPa) + (0.5 х 1352.1 kPa)
Така че:
Pсмес = 864.8 kPa
Бинарна смес с нелетливо разтворено вещество
Понякога се случва, че разтвореното вещество от сместа е нелетливо, така че законът се използва за разбиране на поведението на налягането на парите.
Като се има предвид смес от вода и захар съответно 95% и 5% и при нормални температурни условия:
Xвода = 0.95
Pºвода = 2.34 kPa
Xзахар = 0.05
Pºзахар = 0 kPa
Той се изчислява по закона на Раул:
Pсмес = (0.95 х 2.34 kPa) + (0.05 х 0 kPa)
Така че:
Pсмес = 2.22 kPa
Очевидно е налице понижаване на налягането на водните пари поради ефектите на междумолекулните сили.
препратки
- Anne Marie Helmenstine, P. (s.f.). Дефиниция на закона на Раул. Взето от thoughtco.com
- ChemGuide. (Н.О.). Законът на Раул и нелетливите разтвори. Изтеглено от chemguide.co.uk
- LibreTexts. (Н.О.). Законът на Раул и идеалните смеси от течности. Взето от chem.libretexts.org
- Neutrium. (Н.О.). Законът на Раул. Изтеглено от neutrium.net
- Wikipedia. (Н.О.). Законът на Раул. Изтеглено от en.wikipedia.org


