Характеристики и ограничения на атомния модел на Брогли
на Атомният модел на Бройл е предложен от френския физик Луис Бройли през 1924 г. В докторската си дисертация Брогли твърди, че вълновата частица на електроните е полагала основите на вълновата механика. Брогли публикува важни теоретични изводи за вълнообразния характер на материята в атомния мащаб.
Впоследствие изявленията на Бройл бяха експериментално демонстрирани от учените Клинтън Дейвисън и Лестър Гермер през 1927 година..
Брогли обяви, че материята има поведение, подобно на това на светлината, и предлага подобни свойства в субатомните частици като електрони..
Електрическите заряди и орбитите ограничават амплитудата, дължината и честотата на вълната, описана от електроните. Брогли обясни движението на електроните около атомното ядро.
индекс
- 1 Характеристики на атомния модел на Бройл
- 2 Експериментът на Дейвисън и Гермер
- 3 Ограничения
- 4 статии
- 5 Препратки
Характеристики на атомния модел на Бройл
За да развие предложението си, Брогли започва от принципа, че електроните имат двойна природа между вълната и частицата, подобна на светлината.
В този смисъл Бройл прави сравнение между двете явления и въз основа на уравненията, разработени от Айнщайн за изследване на вълновата природа на светлината, той посочва следното:
- Общата енергия на фотона и следователно общата енергия на електрона се получава от произведението на честотата на вълната и константата на Планк (6.62606957 (29) × 10). -34 Jules x секунди), както е описано в следния израз:
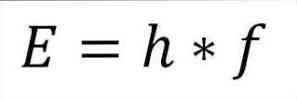
В този израз:
Е = енергия на електрона.
h = константа на дъската.
f = честота на вълната.
- Линейният момент на фотона и следователно на електрона е обратно пропорционален на дължината на вълната и двете величини са свързани чрез константата на Plank:
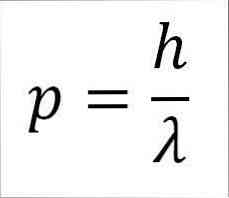
В този израз:
p = линеен момент на електрона.
h = константа на дъската.
λ = дължина на вълната.
- Линейният импулс е произведението на масата на частицата от скоростта, която частицата има по време на своето изместване.
Ако предишният математически израз е преструктуриран като функция от дължината на вълната, имаме следното:
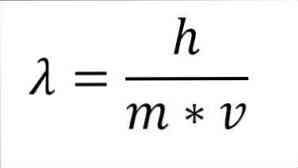
В споменатия израз:
λ = дължина на вълната.
h = константа на дъската.
m = масата на електрона.
v = скорост на електрона.
Тъй като h, константата на Plank, има малка стойност, дължината на вълната λ е също така. Следователно е възможно да се каже, че вълновите свойства на електрона се срещат само на атомни и субатомни нива.
- Бройли също се основава на постулатите на атомния модел на Бор. Според последните орбитите на електроните са ограничени и могат да бъдат само кратни на цели числа. по следния начин:
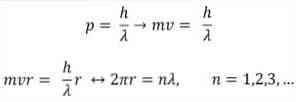
когато:
λ = дължина на вълната.
h = константа на дъската.
m = масата на електрона.
v = скорост на електрона.
r = радиус на орбитата.
n = цяло число.
Според атомния модел на Бор, който Бройл е приел като основа, ако електроните се държат като стоящи вълни, единствените разрешени орбити са онези, чийто радиус е равен на едно цяло число на дължината на вълната λ..
Следователно, не всички орбити отговарят на параметрите, необходими за движението на електрона през тях. Ето защо електроните могат да пътуват само в специфични орбити.
Вълновата теория на електроните на Брогли оправдава успеха на атомния модел на Бор, за да обясни поведението на единния електрон на водородния атом..
Аналогично, тя също така хвърли светлина върху това, защо този модел не се вписва в по-сложни системи, т.е. атоми с повече от един електрон.
Експериментът на Дейвисън и Гермер
Експерименталната проверка на атомния модел на Broglie се провежда 3 години след публикуването й, през 1927 година.
Изтъкнатите американски физици Клинтън Дж. Дейвисън и Лестър Гермер експериментално потвърждават теорията на вълновата механика.
Дейвисън и Гермер са извършили тестове за разсейване на електронен лъч през кристал никел и са наблюдавали феномена на дифракция през металната среда.
Извършеният експеримент включваше следната процедура:
- В първия случай е поставен комплект с електронен лъч, който има известна първоначална енергия.
- Инсталиран е източник на напрежение, за да се ускори движението на електроните, което води до потенциална разлика.
- Потокът от електронния лъч е насочен към метален кристал; в този случай никел.
- Измерва се броят на електроните, които влияят върху никеловия кристал.
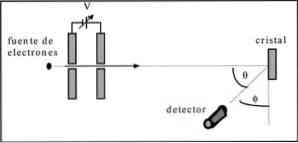
В края на експеримента Дейвисън и Гермер откриват, че електроните са разпръснати в различни посоки.
Чрез повтаряне на експеримента с използване на метални кристали с различна ориентация, учените откриват следното:
- Дисперсията на електронния лъч през металния кристал е сравнима с явлението интерференция и дифракция на светлинните лъчи.
- Отражението на електроните върху кристала на удара описва траекторията, която теоретично трябва да опише според теорията на електронните вълни на Бройл..
В синтеза експериментът на Дейвисън и Гермер експериментално доказа двойната вълнова частица на електроните.
ограничения
Атомният модел на Брогли не предвижда точното местоположение на електрона в орбитата, в която се движи.
В този модел електроните се възприемат като вълни, които се движат около орбитата без определено място, което въвежда понятието електронна орбита.
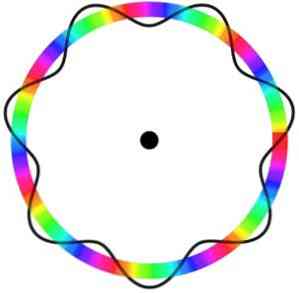
Освен това атомният модел на Брогли, аналогичен на модела на Шрьодингер, не разглежда въртенето на електроните по оста му (въртене).
Като игнорира вътрешния ъглов момент на електроните, пространствените изменения на тези субатомни частици се пренебрегват..
В същия ред на идеите, този модел не взема под внимание промените в поведението на бързите електрони като последица от релативистични ефекти.
Интересни статии
Атомният модел на Шрьодингер.
Атомният модел на Чадуик.
Атомният модел на Хайзенберг.
Атомният модел на Перин.
Атомният модел на Томсън.
Атомният модел на Далтън.
Атомният модел на Дирак Йордания.
Атомният модел на Демокрит.
Атомният модел на Бор.
препратки
- Квантовата теория на Бор и вълните на Де Бройл (s.f.). Възстановен от: ne.phys.kyushu-u.ac.j
- Луи дьо Бройл - биография (1929). © Нобелова фондация. Взето от: nobelprize.org
- Луис-Виктор де Бройл (s.f.). Изтеглено от: chemed.chem.purdue.edu
- Lovett, B. (1998). Луи де Бройл. Encyclopædia Britannica, Inc. Изтеглено от: britannica.com
- Атомният модел на Де Бройл. Национален университет за дистанционно обучение. Испания. Изтеглено от: ocw.innova.uned.es
- Вълните на материята на Луи Де Бройл (с. С.). Получено от: hiru.eus
- Von Pamel, O., and Marchisio, S. (s.f.). Квантова механика Национален университет в Росарио. Взето от: fceia.unr.edu.ar


