Атомният модел на характеристиките на Бора, постулатите, ограниченията
на Атомният модел на Бор е представяне на атома, предложен от датския физик Нилс Бор (1885-1962). Моделът заявява, че електронът се движи по орбити на фиксирано разстояние около атомното ядро, описвайки еднородно кръгово движение. Орбитите - или енергийните нива, както той ги нарича - са с различна енергия.
Всеки път, когато електронът промени орбитата си, той излъчва или абсорбира енергия във фиксирани величини, наречени "кванти". Бор обясни спектъра на излъчваната (или абсорбираната) светлина от водородния атом. Когато един електрон се движи от една орбита към друга към ядрото, се получава загуба на енергия и светлина, с дължина на вълната и енергийни характеристики.

Бор номерира енергийните нива на електрона, като се има предвид, че колкото по-близо е електрона до ядрото, толкова по-ниско е енергийното му състояние. По този начин, колкото по-далеч е електрона от ядрото, толкова по-висок ще бъде броят на енергийните нива и следователно енергийното състояние ще бъде по-високо..
индекс
- 1 Основни характеристики
- 1.1 Тя се основава на други модели и теории на времето
- 1.2 Експериментални доказателства
- 1.3 Електроните съществуват в енергийни нива
- 1.4 Без енергия няма движение на електрона
- 1.5 Брой на електроните във всеки слой
- 1.6 Електроните се въртят в кръгови орбити без излъчваща енергия
- 1.7 Разрешени орбити
- 1.8 Енергия, излъчена или погълната от скокове
- 2 Постулати на атомния модел на Бор
- 2.1 Първи постулат
- 2.2 Втори постулат
- 2.3 Трети постулат
- 3 Диаграма на енергийните нива за водородни атоми
- 4 Трите основни ограничения на модела на Бор
- 5 интересни статии
- 6 Препратки
Основни характеристики
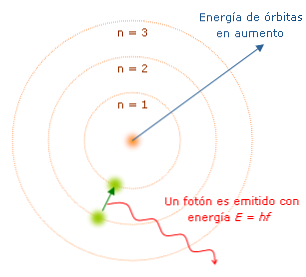
Характеристиките на модела на Бор са важни, тъй като те определят пътя към разработването на по-пълен атомен модел. Основните са:
Тя се основава на други модели и теории на времето
Моделът на Бор е първият, който включва квантовата теория, подкрепена от атомния модел на Ръдърфорд и идеи, взети от фотоелектричния ефект на Алберт Айнщайн. Всъщност Айнщайн и Бор бяха приятели.
Експериментални доказателства
Според този модел, атомите абсорбират или излъчват радиация само когато електроните скачат между разрешените орбити. Немски физици Джеймс Франк и Густав Херц са получили експериментални доказателства за тези състояния през 1914 година.
Електроните съществуват в енергийни нива
Електроните заобикалят ядрото и съществуват на определени енергийни нива, които са дискретни и които са описани в квантовите числа.
Енергийната стойност на тези нива съществува като функция от число n, наречено главно квантово число, което може да се изчисли с уравнения, които ще бъдат подробно описани по-късно.
Без енергия няма движение на електрона
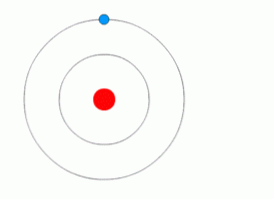
Илюстрацията по-горе показва електрон, който прави квантови скокове.
Според този модел, без енергия няма движение на електрона от едно ниво на друго, точно както без енергия не е възможно да се вдигне обект, който е паднал или отделят два магнита..
Бор предположи, че квантовата енергия е необходима на електрона, за да премине от едно ниво на друго. Той също така заяви, че най-ниското енергийно ниво, заето от електрона, се нарича "основно състояние". "Възбуденото състояние" е по-нестабилно състояние, резултат от преминаването на електрона към по-висока енергийна орбитала.
Брой на електроните във всеки слой
Електроните, които се вписват във всеки слой, се изчисляват с 2n2
Химичните елементи, които са част от периодичната таблица и които са в една и съща колона, имат едни и същи електрони в последния слой. Броят на елетроните в първите четири слоя ще бъде 2, 8, 18 и 32.
Електроните се въртят в кръгови орбити без излъчваща енергия
Според Първия постулат на Бор, електроните описват кръгови орбити около ядрото на атома без излъчваща енергия.
Разрешени са орбити
Според втория постулат на Бор единствените разрешени орбити за електрона са тези, за които ъгловият момент L на електрона е цяло число, кратно на константата на Планк. Математически се изразява по следния начин:
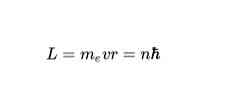
Енергия, излъчена или погълната от скокове
Според Третия постулат, електроните излъчват или поглъщат енергия в скоковете от една орбита към друга. При скока на орбита се излъчва или абсорбира фотон, чиято енергия е представена математически:
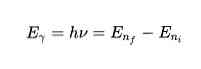
Постулати на атомния модел на Бор
Бор даде приемственост на планетарния модел на атома, според който електроните се въртят около положително заредено ядро, както и планетите около Слънцето..
Този модел обаче оспорва един от постулатите на класическата физика. Според това, частица с електрически заряд (подобно на електрона), която се движи по кръгов път, трябва да губи енергия непрекъснато чрез излъчване на електромагнитно излъчване. Когато губи енергия, електронът ще трябва да следва спирала, докато падне в ядрото.
След това Бор приема, че законите на класическата физика не са най-подходящи за описване на стабилността, наблюдавана в атомите, и той представя следните три постулата:
Първи постулат
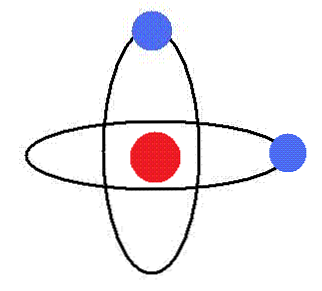
Електронът се върти около ядрото в кръгови орбити, без да излъчва енергия. В тези орбити орбиталният ъглов момент е постоянен.
За електроните на атома се допускат само орбити на определени радиуси, съответстващи на определени енергийни нива.
Втори постулат
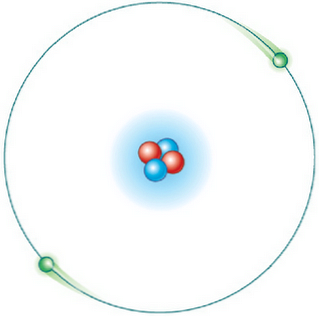
Не всички орбити са възможни. Но след като електрона е в една орбита, която е позволена, тя е в състояние на специфична и постоянна енергия и не отделя енергия (стационарна енергийна орбита).
Например, в водородния атом, разрешените енергии за електрона се дават чрез следното уравнение:
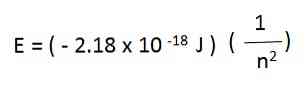
Електронните енергии на водороден атом, генерирани от горното уравнение, са отрицателни за всяка от стойностите на n. Когато n нараства, енергията е по-малко отрицателна и следователно се увеличава.
Когато п е достатъчно голям - например, n = ∞ - енергията е нула и представлява, че електронът е бил освободен и йонизираният атом. Това състояние на нулевата енергия крие по-голяма енергия от състояния с отрицателни енергии.
Трети постулат
Електронът може да се промени от стационарна енергийна орбита към друга чрез излъчване или поглъщане на енергия.
Емитираната или абсорбираната енергия ще бъде равна на енергийната разлика между двете състояния. Тази енергия Е е във формата на фотон и се дава от следното уравнение:
Е = h ν
В това уравнение Е е енергията (абсорбирана или емитирана), h е константата на Планк (нейната стойност е 6.63 х 10).-34 джоул-секунди [J-s]) и ν е честотата на светлината, чиято единица е 1 / s.
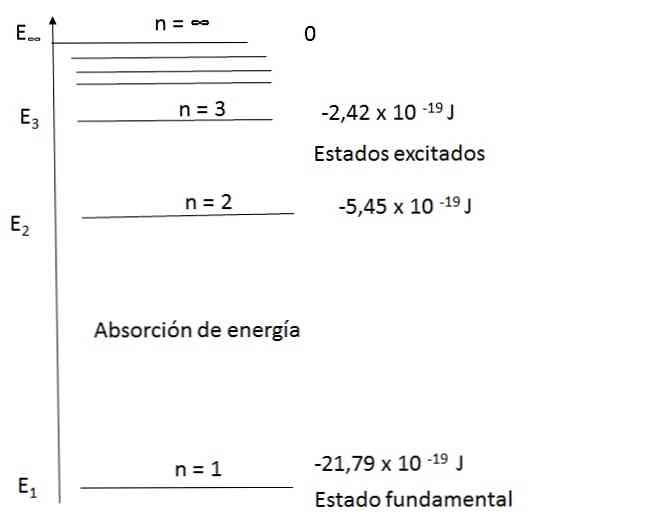
Диаграма на енергийните нива за водородни атоми
Моделът на Бор е в състояние да обясни задоволително спектъра на водородния атом. Например в диапазона от дължини на вълните на видимата светлина емисионният спектър на водородния атом е както следва:
Да видим как можете да изчислите честотата на някои от наблюдаваните светлинни ленти; например, червеният цвят.
Използвайки първото уравнение и замествайки n за 2 и 3 получавате резултатите, които се появяват на диаграмата.

Това е:
За n = 2, Е2 = -5.45 х 10-19 J
За n = 3, Е3 = -2.42 х 10-19 J
След това е възможно да се изчисли енергийната разлика за двете нива:
E = E3 - E2 = (-2.42 - (- 5,45)) х 10 - 19 = 3.43 х 10 - 19 J
Според уравнението, обяснено в третия постулат ΔE = h ν. След това можете да изчислите ν (честотата на светлината):
ν = ΔE / h
Това е:
ν = 3.43 х 10-19 J / 6,63 х 10-34 J-S
ν = 4.56 х 1014 ите-1 или 4.56 x 1014 Hz
Като λ = c / ν и скоростта на светлината c = 3 x 10 8 m / s, дължината на вълната се определя от:
λ = 6 655 х 10 - 7 m (656,5 nm)
Това е стойността на дължината на вълната на червената лента, наблюдавана в спектъра на водородните линии.
Трите основни ограничения на модела на Бор
1 - Той се адаптира към спектъра на водородния атом, но не и към спектрите на други атоми.
2 - Характерните свойства на електрона не са представени в описанието на това като малка частица, която се върти около атомното ядро.
3- Бор не успява да обясни защо класическия електромагнетизъм не се отнася за неговия модел. Т.е. защо електроните не излъчват електромагнитно излъчване, когато се намират в стационарна орбита.
Интересни статии
Атомният модел на Шрьодингер.
Атомният модел на Бройл.
Атомният модел на Чадуик.
Атомният модел на Хайзенберг.
Атомният модел на Перин.
Атомният модел на Томсън.
Атомният модел на Далтън.
Атомният модел на Дирак Йордания.
Атомният модел на Демокрит.
препратки
- Brown, T.L. (2008). Химия: централната наука. Горна река Седл, NJ: зала Pearson Prentice
- Eisberg, R., & Resnick, R. (2009). Квантова физика на атоми, молекули, твърди вещества, ядра и частици. Ню Йорк: Уайли
- Атомният модел на Бор-Зоммерфелд. Изтеглено от: fisquiweb.es
- Joesten, M. (1991). Светът на химията Филаделфия, Пенсилвания: Saunders College Publishing, стр.76-78.
- Модел де Бор де л'атом дхидроген. Получено от fr.khanacademy.org
- Izlar, K. Retrospective sur l'atome: le modèle de Bohr a cent. Изтеглено от: home.cern



