Атомният радиус как се измерва, как се променя периодичната таблица, примери
на атомния радиус той е важен параметър за периодичните свойства на елементите на периодичната таблица. Тя е пряко свързана с размера на атомите, тъй като при по-голям радиус, те са по-големи или обемисти. По същия начин той е свързан с електронните характеристики на същите.
Докато атомът има повече електрони, толкова по-голям е неговият размер и атомния радиус. И двата се определят от електроните на валентната обвивка, тъй като на разстояния извън орбитите им вероятността за намиране на електрон се приближава до нула. Обратното настъпва в околността на ядрото: вероятността за намиране на електрон се увеличава.

Горното изображение представлява опаковка от памучни топки. Имайте предвид, че всеки един е заобиколен от шест съседи, без да се брои друг възможен горен или долния ред. Начинът на уплътняване на памучни топки ще определи размерите им и следователно техните радиуси; точно както се случва с атомите.
Елементите според тяхната химическа природа взаимодействат със собствените си атоми по един или друг начин. Следователно величината на атомния радиус варира в зависимост от вида на присъстващата връзка и твърдата опаковка на нейните атоми.
индекс
- 1 Как се измерва атомният радиус?
- 1.1 Определяне на междуядрената дистанция
- 1.2 Единици
- 2 Как се променя в периодичната таблица?
- 2.1 За период от време
- 2.2 Спускане от група
- 2.3 Свиване на лантанидите
- 3 Примери
- 4 Препратки
Как се измерва атомният радиус?
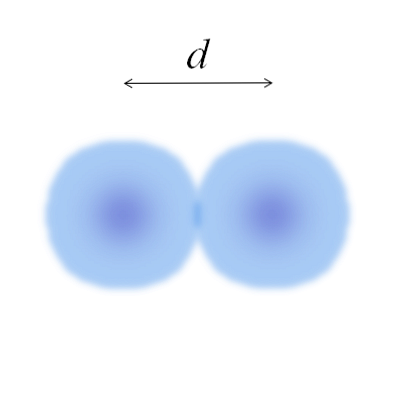
В главното изображение може лесно да се измери диаметъра на памучните топчета и след това да се раздели на две. Обаче сферата на атома не е напълно дефинирана. Защо? Тъй като електроните циркулират и дифузират в специфични области на пространството: орбитали.
Следователно, атомът може да се разглежда като сфера с неопределими ръбове, което е невъзможно да се каже със сигурност до каква степен те завършват. Например, в горното изображение централната област, близо до ядрото, изглежда по-интензивен цвят, а ръбовете й са размазани..
Изображението представлява двуатомна молекула Е2 (като Cl2, Н2, О2, и т.н.). Ако се приеме, че атомите са сферични тела, ако разстоянието е определено г което разделя двата ядра в ковалентната връзка, тогава би било достатъчно да го разделим на две половини (г/ 2) за получаване на атомния радиус; по-точно ковалентният радиус на Е за Е2.
И ако Е не образува ковалентни връзки със себе си, а е метален елемент? след това г това ще бъде посочено от броя на съседите, които обграждат Е в металната му структура; т.е. чрез координационния номер (N.C) на атома в опаковката (помнете памучните топчета от основното изображение).
Определяне на междуядрената дистанция
За да се определи г, което е междуядрено разстояние за два атома в молекула или опаковка, изисква физически техники за анализ.
Една от най-често използваните е рентгеновата дифракция, в която се облъчва лъч светлина през кристал и се изследва дифракционната картина в резултат на взаимодействията между електроните и електромагнитното излъчване. В зависимост от опаковката могат да се получат различни дифракционни картини и следователно други стойности на г.
Ако атомите са "стегнати" в кристалната решетка, те ще представят различни стойности на г в сравнение с това, което биха имали, ако бяха „удобни“. Също така, тези междуядрени разстояния могат да колебаят в стойности, така че атомният радиус действително се състои от средна стойност на такива измервания..
Как е свързан атомният радиус и координационният номер? V. Goldschmidt установява връзка между двете, в която за N.C от 12, относителната стойност е 1; от 0.97 за опаковка, където атомът има N.С, равен на 8; 0,96, за НС, равно на 6; и 0,88 за N.C..
единици
От стойностите за N.C, равни на 12, са построени много таблици, сравняващи атомните радиуси на всички елементи на периодичната таблица..
Тъй като не всички елементи образуват такива компактни структури (N. по-малко от 12), връзката на V. Goldschmidt се използва за изчисляване на техните атомни радиуси и ги изразяват за една и съща опаковка. По този начин измерванията на атомните радиуси са стандартизирани.
Но в какви единици се изразяват? имайки предвид, че г е с много малка величина, трябва да се прибегне до единиците ангстрем Å (10 ∙ 10)-10m) или също широко използван, пикометърът (10. 10)-12т).
Как се променя в периодичната таблица?
През целия период
Определените атомни радиуси за метални елементи се наричат метални радиуси, а за неметалните - ковалентни радиуси (като фосфор, Р4, или сяра, S8). Въпреки това, между двата вида радиостанции има по-ясно различие от името.
От ляво на дясно в същия период, ядрото добавя протони и електрони, но последните са ограничени до същото енергийно ниво (основно квантово число). В резултат на това ядрото упражнява нарастващ ефективен ядрен заряд върху валентните електрони, които свиват атомния радиус.
По този начин неметалните елементи в същия период са склонни да имат атомни (ковалентни) радиуси по-малки от метали (метални радиуси).
Спускане от група
Когато слизате от група, се активират нови нива на енергия, които позволяват на електроните да имат повече пространство. По този начин електронният облак покрива по-големи разстояния, а размазаната му периферия се отдалечава от ядрото и следователно атомният радиус се разширява.
Свиване на лантанидите
Електроните на вътрешния слой помагат за защита на ефективния ядрен заряд на валентните електрони. Когато орбиталите, които съставляват вътрешните слоеве, имат много "дупки" (възли), както при f орбиталите, ядрото силно свива атомния радиус поради лошия екраниращ ефект на орбиталите..
Този факт се доказва в лантанидната контракция в период 6 на периодичната таблица. От La до Hf има значително свиване на атомния радиус, произвеждан от орбиталите f, които "се запълват" при преминаване през блок f: този на лантаноидите и актиноидите.
Подобен ефект може да се наблюдава и с елементите на блока p от период 4. Този времеви продукт на слабия екраниращ ефект на орбиталите d, които запълват при пресичане на периодите на преходните метали.
Примери
За период 2 на периодичната таблица атомните радиуси на нейните елементи са:
-Li: 257 ч
-Бъдете: 112 часа
-В: 88 pm
-С: 77 pm
-N: 74 pm
-О: 66 pm
-F: 64 p.m.
Забележете, че литиевият метал има най-голям атомен радиус (257 p.m.), докато флуорът, разположен в най-дясната част на периода, е най-малката от тях (64 часа). Атомният радиус се спуска от ляво на дясно в същия период и изброените стойности го показват.
Литий, чрез образуване на метални връзки, неговият радиус е метален; и флуор, тъй като образува ковалентни връзки (F-F), неговият радиус е ковалентен.
И ако искате да изразите атомните радиостанции в единици на ангстрем? Просто ги разделяйте на 100: (257/100) = 2.57Å. И така с останалите ценности.
препратки
- Химия 301. Атомна радиа. Извлечено от: ch301.cm.utexas.edu
- Фондация CK-12. (28 юни 2016 г.). Атомният радиус. Изтеглено от: chem.libretexts.org
- Тенденции в атомните радии. Взето от: intro.chem.okstate.edu
- Общински колеж на Клакамас. (2002 г.). Атомен размер. Изтеглено от: dl.clackamas.edu
- Clark J. (август 2012 г.). Атомна и йонна радиус. Възстановен от: chemguide.co.uk
- Shiver & Atkins. (2008 г.). Неорганична химия (Четвърто издание., Стр. 23, 24, 80, 169). Mc Graw Hill.


