Органични соли физични и химични свойства, приложения и примери
на органични соли те са плътен брой йонни съединения с безброй характеристики. Те произтичат преди това от органично съединение, което е претърпяло трансформация, която му позволява да бъде носител на заряд, и че също така нейната химична идентичност зависи от асоциирания йон..
На снимката по-долу са показани две много общи химични формули за органични соли. Първият, R-AX, се интерпретира като съединение, в чиято въглеродна структура атом, или група А, носи положителен заряд + или отрицателен (-).
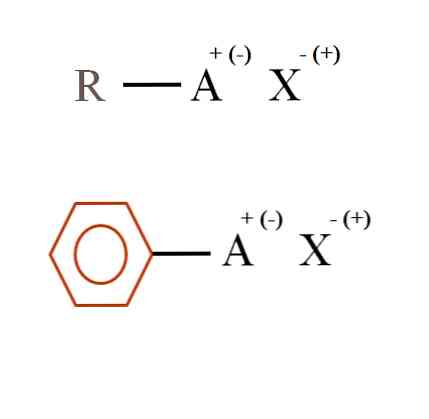
Както може да се види, има ковалентна връзка между R и A, R-A, но на свой ред А има формален заряд, който привлича (или отблъсква) X-йона..
Ако А са положителни, с колко X може да взаимодейства? Само с един, като се има предвид принципа на електронейтралността (+ 1-1 = 0). Но каква е идентичността на X? Анионът X може да бъде СО32-, изискващи две катиони RA+; халогенид: F-, Cl-, Br-, и т.н .; или дори друго съединение RA-. Опциите са неизчислими.
Също така, органичната сол може да има ароматен характер, илюстриран в кафявия бензенов пръстен. Солта на меден бензоат (II), (С6Н5COO)2Си, например, се състои от два ароматни пръстена с отрицателно заредени карбоксилни групи, които взаимодействат с Cu катиона.2+.
индекс
- 1 Физични и химични свойства
- 1.1 Високомолекулни маси
- 1.2 Амфифили и повърхностноактивни вещества
- 1.3 Високи температури на кипене или на топене
- 1.4 Киселинност и основност
- 2 Използване
- 3 Примери за органични соли
- 3.1 Карбоксилати
- 3.2 Литиев диакрилупрат
- 3.3 Соли на сулфония
- 3.4 Соли на оксоний
- 3.5 Аминокиселини
- 3.6 Диазониеви соли
- 4 Препратки
Физични и химични свойства
От изображението може да се каже, че органичните соли се състоят от три компонента: органичен, R или Аг (ароматен пръстен), атом или група, носеща йонния заряд А, и противойон X.
Точно както химическата идентичност и структура се определят от такива компоненти, така и техните свойства зависят от тях.
От този факт могат да се обобщят някои общи свойства, които отговарят на по-голямата част от тези соли.
Високомолекулни маси
Приемайки моно или поливалентни неорганични X аниони, органичните соли обикновено имат много по-големи молекулни маси от неорганичните соли. Това се дължи главно на въглеродния скелет, чиито обикновени С-С връзки и техните водородни атоми допринасят много за масата на съединението.
Следователно, те са R или Ar, отговорни за техните високи молекулни тегла.
Амфифили и повърхностноактивни вещества
Органичните соли са амфифилни съединения, т.е. техните структури имат хидрофилни и хидрофобни краища.
Какви са тези крайности? R или Ar представляват хидрофобния край, тъй като техните С и Н атоми нямат голям афинитет към водни молекули.
А+(-), атомът или групата, носеща заряда, е хидрофилният край, тъй като допринася за диполния момент и взаимодейства с диполите, образуващи вода (RA)+ OH2).
Когато хидрофилните и хидрофобните области са поляризирани, амфифилната сол става повърхностно активно вещество, вещество, широко използвано за производството на детергенти и антиемулгиращи.
Високи температури на кипене или топене
Подобно на неорганичните соли, органичните соли също имат високи точки на топене и кипене, поради електростатичните сили, които управляват в течна или твърда фаза.
Въпреки това, имайки органичен компонент R или Ar, други видове ван дер ваалсови сили (Лондонски сили, дипол-дипол, водородни мостове), които се конкурират по определен начин с електростатични.
Поради тази причина, твърдите или течните структури на органичните соли са, на първо място, по-сложни и разнообразни. Някои от тях дори могат да се държат така течни кристали.
Киселинност и основност
Органичните соли обикновено са по-силни киселини или основи, отколкото неорганичните соли. Това е така, защото А, например в аминовите соли, има положителен заряд, дължащ се на неговата връзка с допълнителен водород: А+-H. След това, в контакт с база, дарете протона да се върне, за да бъде неутрално съединение:
RA+Н + В => RA + HB
H принадлежи към A, но е написано, когато се намесва в реакцията на неутрализация.
От друга страна, RA+ тя може да бъде голяма молекула, неспособна да образува твърди вещества с кристална мрежа, достатъчно стабилна с хидроксилния анион или хидроксил ОН-.
Когато това е така, сол RA+OH- той се държи като силна основа; дори като основен като NaOH или KOH:
RA+OH- + НС1 => RAC1 + H2О
Забележете в химичното уравнение, че Cl аниона- той замества OH-, образуване на сол RA+Cl-.
приложения
Използването на органични соли ще варира в зависимост от идентичността на R, Ar, А и X. Освен това, приложението, към което те са предназначени, също зависи от вида на твърдата или течната форма, която те образуват. Някои общи положения в това отношение са:
-Те служат като реагенти за синтез на други органични съединения. RAX може да действа като "донор" на R веригата, за да бъде добавена към друго съединение, заместващо добра изходяща група.
-Те са повърхностно активни вещества, така че могат да се използват и като смазочни материали. За тази цел се използват метални соли на карбоксилати.
-Те позволяват да се синтезира широк спектър от багрила.
Примери за органични соли
карбоксилати
Карбоновите киселини реагират с хидроксид в реакция на неутрализация, което води до получаване на соли на карбоксилати: RCOO- М+; където М+ Тя може да бъде всеки метален катион (Na+, Pb2+, K+, и т.н.) или NH амониев катион4+.
Мастните киселини са алифатни карбоксилни киселини с дълга верига, те могат да бъдат наситени и ненаситени. Палмитиновата киселина (CH) е сред наситените3(СН2)14СООН). Това произтича от палмитатна сол, докато стеариновата киселина (СН3(СН2)16СООН образува стеаратната сол. Сапуните са съставени от тези соли.
В случая на бензоена киселина, С6Н5COOH (където С6Н5- това е бензенов пръстен), когато реагира с основа, образува бензоатни соли. Във всички карбоксилати, групата -СОО- представлява A (RAX).
Литиеви диабюрати
Литиевият диакупрат е полезен в органичния синтез. Формулата му е [R-Cu-R]-Ли+, в която медният атом носи отрицателен заряд. Тук медта представлява атома А на образа.
Сулфониеви соли
Те се образуват от реакцията на органичен сулфид с алкилхалогенид:
R2S + R'X => R2R'S+X
За тези соли, серният атом носи положителен формален заряд (S+) с три ковалентни връзки.
Оксониеви соли
Също така, етерите (окислените аналози на сулфидите) реагират с хидроцидите за образуване на оксониеви соли:
ROR '+ HBr <=> RO+HR '+ Br-
Киселинният протон на НВг е ковалентно свързан с кислородния атом на етера (R2О+-H), зареждайки го положително.
Аминни соли
Амините могат да бъдат първични, вторични, третични или четвъртични, както и техни соли. Всички те се характеризират с наличието на Н атом, свързан с азотния атом.
Така че, RNH3+X- това е сол на първичен амин; R2NH2+X-, на вторичен амин; R3NH+X-, на третичен амин; и R4N+X-, кватернерни амини (кватернерни амониеви соли).
Диазониеви соли
Накрая, диазониевите соли (RN2+X-) или арилдиазоний (ArN)2+X-), представляват отправна точка за много органични съединения, особено азо багрила.
препратки
- Франсис А. Кери. Органична химия (Sixth edition., Pp. 604-605, 697-698, 924). Mc Graw Hill.
- Греъм Соломонс T.W., Крейг Б. Фрайле. Органична химия. Амини. (10-то издание.). Wiley Plus.
- Wikipedia. (2018). Сол (химия). Взето от: en.wikipedia.org
- Стивън А. Хардингър. (2017). Илюстриран речник на органичната химия: соли. Изтеглено от: chem.ucla.edu
- Шеврон Оронит. (2011 г.). Карбоксилати. [PDF]. Изтеглено от: oronite.com


