Структура, свойства, приложения, токсичност на въглероден тетрахлорид (CCl4)
на тетрахлорметан Това е безцветна течност, с малко сладка миризма, подобна на миризмата на етер и хлороформ. Химичната му формула е CCl4, и представлява ковалентно и летливо съединение, чиято пара е с по-голяма плътност от въздуха; Не е благоприятно за електричеството, нито е запалимо.
Намира се в атмосферата, водата на реките, морето и утайките на морската повърхност. Смята се, че въглеродният тетрахлорид в червените водорасли се синтезира от един и същ организъм.
В атмосферата се получава чрез реакция на хлор и метан. Производственият въглероден тетрахлорид навлиза в океана, главно през интерфейса море-въздух. Изчислено е, че нейният атмосферен поток => океански е 1,4 х 1010 g / година, еквивалентни на 30% от общия въглероден тетрахлорид на атмосферата.
индекс
- 1 Основни характеристики
- 2 Структура
- 3 Физични и химични свойства
- 4 Използване
- 4.1 Химическо производство
- 4.2 Производство на хладилни агенти
- 4.3 Предотвратяване на пожар
- 4.4 Почистване
- 4.5 Химичен анализ
- 4.6 Инфрачервена спектроскопия и ядрено-магнитен резонанс
- 4.7 Разтворител
- 4.8 Други употреби
- 5 Токсичност
- 5.1 Хепатотоксични механизми
- 5.2 Токсични ефекти върху бъбречната система и централната нервна система
- 5.3 Ефекти от експозицията на човека
- 5.4 Токсични взаимодействия
- 6 Междумолекулни взаимодействия
- 7 Препратки
Основни характеристики
Въглеродният тетрахлорид се произвежда индустриално чрез термично хлориране на метан, като метанът реагира с хлорен газ при температура между 400 ° С и 430 ° С. По време на реакцията се получава суров продукт с страничен продукт от солна киселина.
Той се произвежда също така и индустриално чрез въглероден дисулфиден метод. Хлорът и въглеродният дисулфид реагират при температура от 90 ° С до 100 ° С, като се използва желязо като катализатор. След това суровият продукт се подлага на фракциониране, неутрализация и дестилация.
CCl4 има многократна употреба, наред с другото: разтворител на мазнини, масла, лакове и др .; Химическо чистене на дрехи; пестициди, в селскостопанска и фунгицидна фумигация и производство на найлон. Въпреки това, въпреки голямата си полезност, използването му е частично изключено поради високата токсичност.
При хората той генерира токсични ефекти върху кожата, очите и дихателните пътища. Но най-вредните му ефекти възникват във функционирането на централната нервна система, черния дроб и бъбреците. Увреждането на бъбреците е може би основната причина за смъртните случаи, дължащи се на токсичното действие на тетрахлорметан.
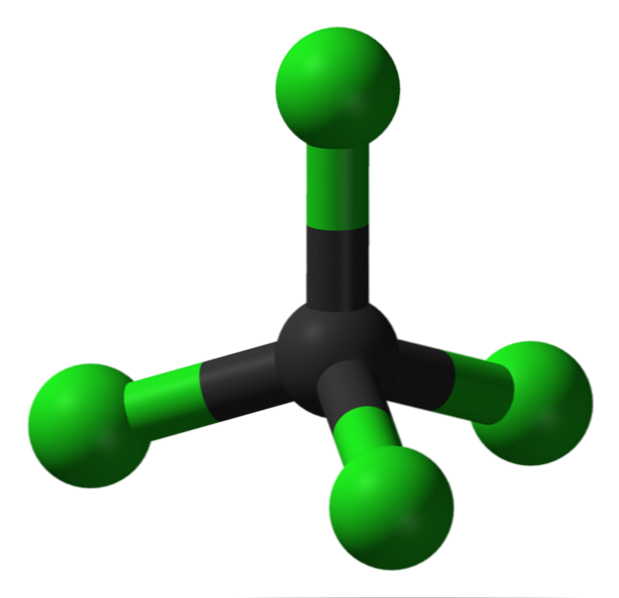
структура
В изображението можете да видите структурата на въглероден тетрахлорид, който е тетраедрична геометрия. Отбележете, че атомите С1 (зелените сфери) са ориентирани в пространството около въглерода (черната сфера) чрез изчертаване на тетраедър..
Също така си струва да се отбележи, че тъй като всички върхове на тетраедъра са идентични, структурата е симетрична; няма значение как се върти CCl молекулата4, Винаги ще бъде същото. Тогава, след като зеления тетраедър на CCl4 е симетричен, има като следствие липсата на постоянен диполен момент.
Защо? Защото, въпреки че С-Cl връзките са полярни поради по-голямата електроотрицателност на С1 по отношение на С, тези моменти са отменени vectorially. Следователно, това е неполярно хлорирано органично съединение.
Въглеродът е напълно хлориран в CCl4, това, което е равно на високо окисление (въглеродът може да образува максимум четири връзки с хлор). Този разтворител не е склонен да губи електрони, той е апротичен (няма водороди) и представлява средство за транспорт и малко съхранение на хлор..
Физични и химични свойства
формула
ССЦ4
Молекулно тегло
153,81 g / mol.
Физически вид
Това е безцветна течност. Кристализира под формата на моноклинни кристали.
миризма
Представя характерния мирис, присъстващ в други хлорирани разтворители. Миризмата е ароматна и донякъде сладка, подобна на миризмата на тетрахлоретилен и хлороформ..
Точка на кипене
170,1 ° F (76,8 ° С) до 760 mmHg.
Точка на топене
-9ºF (-23ºC).
Разтворимост във вода
Той е слабо разтворим във вода: 1.16 mg / mL при 25ºC и 0.8 mg / mL при 20ºC. Защо? Тъй като водата, силно полярна молекула, не "чувства" афинитет към въглероден тетрахлорид, който е неполярен.
Разтворимост в органични разтворители
Поради симетрията на неговата молекулярна структура, въглеродният тетрахлорид е неполярно съединение. Следователно, той се смесва с алкохол, бензол, хлороформ, етер, въглероден дисулфид, петролев етер и нафта. По същия начин, той е разтворим в етанол и ацетон.
плътност
В течно състояние: 1.59 g / ml при 68 ° F и 1.594 g / ml при 20 ° C.
В твърдо състояние: 1.831 g / ml при -186 ° С и 1.809 g / ml при -80 ° С.
стабилност
Обикновено инертен.
Разяждащо действие
Атакува някои форми на пластмаси, гуми и покрития.
Точка на запалване
Счита се, че не е лесно запалим, което показва, че точката на запалване е по-малка от 982 ° C.
Автоматично запалване
982 ° С (1800 ° F; 1255 К).
Плътност на парите
5.32 по отношение на въздуха, взето като референтна стойност, равна на 1.
Парно налягане
91 mmHg при 68 ° F; 113 mmHg при 77 ° F и 115 mmHg при 25 ° С.
разлагане
При наличие на огън се образува хлорид и фосген, силно токсично съединение. По същия начин, при същите условия той се разлага на хлороводород и въглероден оксид. В присъствието на вода при високи температури може да предизвика солна киселина.
вискозитет
2.03 х 10-3 Pa · s
Праг на мирис
21,4 ррт.
Индекс на рефракция (ηD)
1.4607.
приложения
Химическо производство
-Той действа като хлориращ агент и / или разтворител при производството на органичен хлор. По същия начин, той се намесва като мономер в производството на найлон.
-Действа като разтворител при производството на каучуков цимент, сапун и инсектицид.
-Той се използва за производството на хлорофлуоровъглеводороден пропелант.
-При липсата на С-Н връзки, въглеродният тетрахлорид не претърпява реакции на свободни радикали, така че е полезен разтворител за халогениране, или чрез елементарен халоген, или с халогениращ реагент, като N-бромосукцинимид..
Производство на хладилни агенти
Използва се при производството на хлорофлуоровъглерод, хладилен агент R-11 и трихлорофлуорометан, хладилен агент R-12. Тези хладилни агенти разрушават озоновия слой, поради което препоръчват прекратяване на употребата им, съгласно препоръките на Монреалския протокол..
Потискане на пожар
В началото на 20-ти век, въглероден тетрахлорид започва да се използва като пожарогасител, базиран на набор от свойства на съединението: той е летлив; неговите пари са по-тежки от въздуха; Той не е електрически проводник и не е лесно запалим.
При нагряване тетрахлорметанът се превръща в тежък пара, който покрива продуктите на горенето, като ги изолира от присъстващия във въздуха кислород и причинява смъртта на огъня. Подходящ е за борба с нефтените пожари и уреди.
Въпреки това, при температури над 500 ° C, въглероден тетрахлорид може да реагира с вода, което води до токсичен състав на фосген, така че трябва да се обърне внимание на вентилацията по време на употреба. Освен това, той може да реагира експлозивно с метален натрий, като избягва използването му при пожари с присъствието на този метал.
почистване
Въглеродният тетрахлорид се използва за химическо чистене на дрехи и други материали за употреба в дома. В допълнение, той се използва като индустриален обезмаслител за метали, отличен за разтваряне на мазнини и масла.
Химичен анализ
Използва се за откриване на бор, бромид, хлорид, молибден, волфрам, ванадий, фосфор и сребро.
Инфрачервена спектроскопия и ядрено-магнитен резонанс
-Използва се като разтворител в инфрачервената спектроскопия, тъй като тетрахлорметан не притежава значителна абсорбция в ленти> 1600 см-1.
-Използва се като разтворител в ядрено-магнитен резонанс, тъй като не пречи на техниката, тъй като не притежава водород (апротонен). Но поради своята токсичност и поради ниската си разтворима мощност, въглеродният тетрахлорид е заменен с деутерирани разтворители..
разредител
Характеристиката, че е неполярна смес, позволява използването на тетрахлорметан като разтворител за масла, мазнини, лакове, лакове, каучукови восъци и смоли. Той може също така да разтвори йод.
Други приложения
-Той е важен компонент в лампите от лава, тъй като поради своята плътност тетрахлорметанът добавя тежест към восъка.
-Използва се от колекционери на марки, тъй като разкрива водни знаци върху печати, без да причинява щети.
-Той е бил използван като пестицид, фунгицид и в пръскането на зърна, за да елиминира насекомите.
-В процеса на рязане на метал се използва като смазка.
-Използван е във ветеринарната медицина като антихелминт в лечението на фасциолаза, причинена от Fasciola hepatica in ovce.
токсичност
-Въглеродният тетрахлорид може да се абсорбира през дихателните, храносмилателните, очните и кожните пътища. Поглъщането и вдишването са много опасни, защото могат да причинят дълготрайни тежки увреждания на мозъка, черния дроб и бъбреците.
-Контактът с кожата предизвиква дразнене и в дългосрочен план може да предизвика дерматит. Докато контактът с очите предизвиква дразнене.
Хепатотоксични механизми
Основните механизми, които причиняват увреждане на черния дроб, са оксидативен стрес и промяна на калциевата хомеостаза..
Окислителният стрес е дисбаланс между производството на реактивни кислородни видове и способността на тялото да генерира редуцираща среда в техните клетки, която контролира окислителните процеси.
Дисбалансът в нормалното редокс състояние може да предизвика токсични ефекти от производството на пероксиди и свободни радикали, които увреждат всички компоненти на клетките.
Въглеродният тетрахлорид се метаболизира произвеждайки свободни радикали: Cl3C. (радикал трихлорометил) и С13COO. (радикал трихлорометилпероксид). Тези свободни радикали предизвикват липопероксидация, която причинява увреждане на черния дроб, а също и на белия дроб.
Свободните радикали също причиняват разкъсване на плазмената мембрана на чернодробните клетки. Това води до повишаване на цитозолната концентрация на калций и намаляване на вътреклетъчния механизъм на калциева секвестрация.
Вътреклетъчното увеличение на калция активира ензима фосфолипаза А2 който действа върху фосфолипидите на мембраната, утежнява неговото въздействие. Освен това има инфилтрация на неутрофили и хепатоцелуларно увреждане. Налице е намаляване на клетъчната концентрация на АТР и глутатион, което причинява ензимна инактивация и клетъчна смърт.
Токсични ефекти в бъбречната система и централната нервна система
Токсичните ефекти на въглероден тетрахлорид се проявяват в бъбречната система с намаляване на производството на урината и натрупването на вода в тялото. Особено в белите дробове и повишаване на концентрацията на метаболитни отпадъци в кръвта. Това може да причини смърт.
На нивото на централната нервна система има участие на аксонова проводимост на нервните импулси.
Ефекти от експозицията на човека
Краткотрайно
Дразнене на очите; ефекти върху черния дроб, бъбреците и централната нервна система, може да доведе до загуба на съзнание.
Дълга продължителност
Дерматит и възможно канцерогенно действие.
Токсични взаимодействия
Съществува връзка между много от случаите на интоксикация с въглероден тетрахлорид и консумация на алкохол. Прекомерният прием на алкохол причинява увреждане на черния дроб, което в някои случаи води до цироза на черния дроб.
Наблюдавано е, че токсичността на въглероден тетрахлорид се увеличава с барбитурати, тъй като те имат някои подобни токсични ефекти.
Например, при бъбречното ниво, барбитуратите намаляват отделянето на урина, като това действие на барбитурати е подобно на токсичния ефект на въглеродния тетрахлорид върху бъбречната функция..
Междумолекулни взаимодействия
CCl4 Може да се разглежда като зелен тетраедър. Как взаимодейства с другите?
Като аполарна молекула, без постоянен диполен момент, тя не може да взаимодейства с дипол-диполните сили. За да задържат молекулите си заедно в течността, хлорните атоми (върховете на тетраедрата) трябва да взаимодействат помежду си по някакъв начин; и те успяват благодарение на дисперсионните сили на Лондон.
Електронните облаци на Cl-атомите се движат и за кратки моменти генерират богати и бедни зони на електрони; т.е. те генерират мигновени диполи.
Богатата площ на електроните δ- причинява поляризацията на Cl-атома на съседна молекула: Clδ-δ+Cl По този начин два Cl атома могат да се държат заедно за ограничен период от време.
Но имайки милиони молекули CCl4, взаимодействията стават достатъчно ефективни, за да образуват течност при нормални условия.
Освен това, четирите С1, свързани ковалентно с всеки С, значително увеличават броя на тези взаимодействия; толкова много, че кипи при 76,8ºC, висока точка на кипене.
Точката на кипене на CCl4 тя не може да бъде по-висока, защото тетраедрите са сравнително малки в сравнение с други аполарни съединения (като ксилол, който кипи при 144 ° С).
препратки
- Хардингер Стивън. (2017). Илюстриран речник на органичната химия: Въглероден тетрахлорид. Изтеглено от: chem.ucla.edu
- Всички Siyavula. (Н.О.). Междумолекулни и междуатомни сили. Изтеглено от: siyavula.com
- Кери Ф. А. (2006). Органична химия (Шесто издание). Mc Graw Hill.
- Wikipedia. (2018). Въглероден тетрахлорид. Изтеглено от: en.wikipedia.org
- PubChem. (2018). Въглероден тетрахлорид. Възстановен от: pubchem.ncbi.nlm.nih.gov
- Химическа книга. (2017). Въглероден тетрахлорид. Изтеглено от: chemicalbook.com


