Основа на кръвта от агар, употреби и подготовка
на кръвен агар тя е обогатена твърда среда, диференциална, но не селективна. Използва се за възстановяване и растеж на голямо разнообразие от микроорганизми от клинични проби или субкултури.
Класически кръвен агар трябва да бъде включен за посяване на повечето клинични проби, получени в лабораторията; с изключение на проби от изпражнения, където не е полезно, освен ако не са приготвени с определени модификации.
Тази културална среда е съставена основно от обогатен основен агар и 5% кръв. Основата на агара може да варира в зависимост от нуждите, но основно ще се състои от пептони, аминокиселини, витамини, месен екстракт, натриев хлорид, агар и др..
Що се отнася до кръвта, обикновено се изисква да има контакт с биотериум, за да се получи кръв от животни, като овце, заек или кон. Това обаче не винаги е възможно и понякога се използва човешка кръв.
Кръвната агарова среда може да бъде приготвена в лаборатория или може да бъде закупена готова за фирми, които са предназначени за нея. Приготвянето на тази среда е една от най-деликатните, всяка небрежност при нейното приготвяне ще доведе до замърсена партида.
Ето защо трябва да се вземат всички възможни предпазни мерки и в крайна сметка да се извърши качествен контрол на инкубатор при 37 ° C 1 плака за всеки 100.
индекс
- 1 Фондация
- 2 Използване
- 2.1 Избор на кръвна група
- 2.2. Избор на основен тип агар
- 2.3 Използване на кръвен агар според основната среда, използвана за неговото приготвяне
- 3 Подготовка
- 3.1 Претегля се и се разтваря
- 3.2 Стерилизирайте
- 3.3 Агрегиране на кръв
- 3.4 Изсипете в блюда от Петри
- 4 Препратки
фундамент
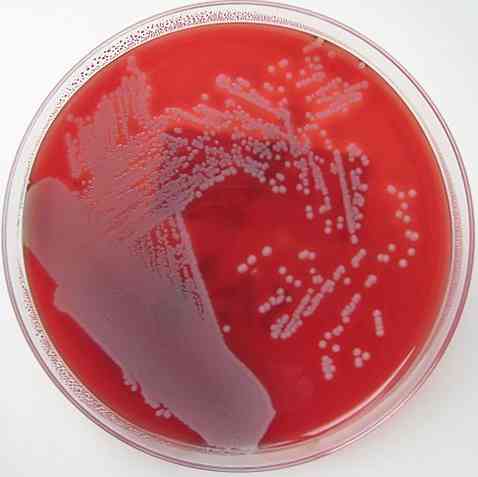 Вече беше споменато, че кръвният агар има характеристиката да е обогатена, диференциална и неселективна среда. Основата на всяко от тези свойства е обяснена по-долу.
Вече беше споменато, че кръвният агар има характеристиката да е обогатена, диференциална и неселективна среда. Основата на всяко от тези свойства е обяснена по-долу.
Кръвен агар е обогатена среда, тъй като има основна добавка 5-10% кръв на агарова основа. И двете съединения съдържат много хранителни вещества и това свойство позволява на повечето от култивируемите бактерии да растат в него.
Този растеж се осъществява без ограничения; поради тази причина тя не е селективна. Въпреки това, ако към тази среда се добавят съединения, които предотвратяват растежа на някои микроорганизми и благоприятстват растежа на други, то става селективно. Такъв е случаят, ако се добавят някои видове антибиотици или противогъбични средства.
По същия начин, кръвен агар е диференциална среда, тъй като позволява да се разграничат три вида бактерии: бета-хемолитични, алфа-хемолитични и гама-хемолитични..
Бета-хемолитиците са тези, които имат способността да лизират или напълно да прекъсват червените кръвни клетки, образувайки ясен ореол около колониите, като по този начин произвеждат ß или β хемолиза - хемолиза и микроорганизми се наричат ß-хемолитични.
Примери за ß-хемолитични бактерии са Streptococcus pyogenes и Streptococcus agalactiae.
Алфа-хемолитиците са тези, които извършват частична хемолиза, където хемоглобинът се окислява до метхемоглобин, генерирайки зеленикаво оцветяване около колониите. Това явление е известно като хемолиза α или α-хемолиза и бактериите са класифицирани като α-хемолитични.
Пример за а-хемолитични бактерии са Streptococcus pneumoniae и стрептокок от групата зеленеещи.
Накрая, има бактерии, наречени гама-хемолитични или нехемолитични. Те растат на агара, без да предизвикват промени в него, ефект, известен като γ-хемолиза, а микроорганизмите са γ-хемолитични.
Пример за γ-хемолитични бактерии: някои щамове на Streptococcus от група D (Streptococcus bovis и Enterococcus faecalis).
приложения
Кръвната среда на кръвен агар е една от най-често използваните в микробиологичната лаборатория.
Сред микроорганизмите, способни да растат в кръвната агарова среда, са: строги, факултативни, микроаерофилни, анаеробни, грам-положителни или грам-отрицателни аеробни бактерии, бързорастящи или бавно растящи бактерии..
Някои бактерии, които са взискателни или притеснителни от хранителна гледна точка, както и гъбички и дрожди, също растат. По същия начин е полезно да се субкултивират или реактивират щамове, които са много слаби метаболитно.
Изборът на кръвна група и основен агар обаче ще варира в зависимост от вероятния микроорганизъм, за който се подозира, че е възстановен, и от използването на плаката (култура или антибиограма)..
Избор на кръвна група
Кръвта може да бъде агне, заек, кон или човек.
Най-препоръчителната е агнешката кръв, с някои изключения. Например, за да се изолират Haemophilus видове, където препоръчителната кръв е кон или заек, тъй като кръвта на агнетата има ензими, които инхибират фактор V.
Най-малко препоръчва се човекът, но той е най-използваният, може би защото е най-лесно да се получи.
Кръвта трябва да бъде дефибринирана, получена без каквато и да е добавка и от здрави животни. За използването на човешка кръв трябва да се имат предвид няколко фактора:
Ако кръвта идва от индивиди, които са претърпели бактериални инфекции, те ще имат специфични антитела. При тези условия е вероятно растежът на някои бактерии да бъде инхибиран.
Ако се получи от банката на кръвта, тя съдържа цитрат и е възможно някои бактерии да не се развият в неговото присъствие. От друга страна, ако кръвта идва от пациенти, които приемат антибиотици, растежът на податливите бактерии може да бъде блокиран.
И ако кръвта е от диабетно лице, излишната глюкоза се намесва в правилното развитие на моделите на хемолиза.
Избор на основен тип агар
Основният агар, използван за приготвяне на кръвен агар, може да бъде много широк. Сред тях са: хранителен агар, инфузионен агар на мозъчната сърце, соев агар, триптиказ, Мюлеровият агар, Thayer Martin агар, Колумбийски агар, Brucella агар, Campylobacter agar и др..
Употреба на кръвен агар според основната среда, използвана за неговото приготвяне
Хранителен агар
Тази база е най-малко използвана, защото върху нея ще растат главно не-изискващи бактерии, като например чревни бактерии, Pseudomonas sp, S. aureus, Bacillus sp, между другото. Не се препоръчва изолиране на Streptococcus.
Агар за инфузия на сърцето (BHI)
Той е един от най-използваните като основа за кръвен агар, защото има необходимите хранителни вещества за растежа на повечето бактерии, включително Streptococcus sp и други взискателни бактерии. Въпреки че не е подходящо да се наблюдават модели на хемолиза.
С тази основа обикновено се използва агнешка кръв.
Могат да се приготвят и варианти на кръвен агар, където се добавят други съединения, за да се изолират определени микроорганизми. Например, агар за мозъчна инфузия, допълнен с заешка кръв, цистин и глюкоза, служи за изолиране Francisella tularensis.
Като има предвид, че с цистин телурит е полезен за изолирането на Corynebacterium diphteriae. Можете да използвате човешка или агнешка кръв.
С първата бета-хемолиза ще изглежда като тесен ореол, докато при втория хало ще бъде много по-широк.
По същия начин, тази основа заедно с бацитрацин, царевично нишесте, конска кръв и други добавки за обогатяване (IsoVitaleX), се използва за изолиране на рода Haemophilus sp от респираторни проби.
Също така, ако добавите комбинацията от антибиотици хлорамфеникол - гентамицин или пеницилин - стрептомицин с конска кръв, тя е идеална за изолиране на взискателни патогенни гъби, дори и с по-висок добив от глюкозния агар Sabouraud. Това е особено полезно в изолацията Histoplasma capsulatum.
Трипсивна соя
Тази база е най-препоръчителна за по-добро наблюдение на модела на хемолиза и извършването на диагностични тестове като таксони на оптоквин и бацитрацин. Това е класическият кръвен агар, който се използва рутинно.
С тази основа можете да приготвите специален кръвен агар Corynebacterium diphteriae, с телуров цистин и Агнешка кръв.
По същия начин, комбинацията от този агар с агнешка кръв плюс канамицин-ванкомицин е идеална за растежа на анаероби, особено Bacteroides sp.
Агар Мюлер Хинтън
Тази база, допълнена с кръв, се използва за извършване на антибиограма на взискателни микроорганизми, като например Streptococcus sp.
Също така е полезна за изолиране на бактерии като Legionella pneumophila.
Агар Тейър Мартин
Тази среда е идеална като основа за кръвен агар, когато се подозира родът Neisseria, особено Neisseria meningitidis, като N. gonorrhoeae не расте върху кръвен агар.
Той служи и за извършване на тестове за чувствителност Neisseria meningitidis.
Агар Колумбия
Тази база е отлична за засяване на проби от стомашни биопсии в търсене на Helicobacter pylori.
Средата се приготвя чрез добавяне на 7% агнешка кръв, дефибринирана с антибиотици (ванкомицин, триметоприм, амфотерицин В и цефсулодин), за да се ограничи растежа на други видове бактерии, които могат да присъстват..
Същата база, допълнена с човешка или агнешка кръв, налидиксова киселина и колистин е полезна за изолиране Gardnerella vaginalis. Също така е идеален за оценка на антимикробната чувствителност към антибиотици от същия микроорганизъм.
В допълнение, той се използва за приготвяне на кръвен агар за култивиране на анаероби, добавяне на аминогликозиди и ванкомицин..
Тази база ни позволява да наблюдаваме правилно моделите на хемолиза.
Бруцела агар
Тази среда, използвана като основа за кръвен агар заедно с добавянето на витамин К, е идеална за отглеждане на анаеробни бактерии. В този случай се препоръчва използването на агнешка кръв.
Campylobacter agar
Амидът Campylobacter, допълнен с 5% овча кръв и 5 антибиотици (цефалотин, амфотерицин В, триметоприм, полимиксин В и ванкомицин), е средата, използвана за изолиране Campylobacter jejuni в проби от изпражнения.
подготовка
Всяка търговска къща поставя в задната част на опаковката инструкциите за приготвяне на литър хранителна среда. Съответните изчисления могат да бъдат направени за получаване на желаното количество, съгласно избрания основен агар.
Претегля се и се разтваря
Основният агар идва дехидратиран (прах), така че той трябва да бъде разтворен в дестилирана вода, коригирана до рН 7.3.
Количеството, посочено от избрания основен агар, се претегля и разтваря в съответното количество вода в фиола, след което се нагрява до умерено нагряване и се смесва с въртящи се движения, докато целият прах се разтвори..
стерилизирам
След като се разтвори, стерилизира се в автоклав при 121 ° С в продължение на 20 минути.
Състав на кръв
Когато излизате от автоклава, оставете фиола да се охлади, докато температурата се колебае между 40 до 50 ° С; е температура, която човешката кожа поддържа и в същото време агарът все още не се втвърдява.
За тази цел, фиола се докосва с ръка и ако топлината е поносима, идеалната температура е да се добави съответното количество дефибринирана кръв (50 ml на литър агар). Разбъркайте внимателно за хомогенизиране.
Преминаването на агрегата на кръвта е от решаващо значение, защото ако се прави, когато средата е много гореща, червените кръвни клетки ще се счупят и средата няма да служи за наблюдение на хемолизата..
Ако се добави прекалено студено, ще се образуват бучки и повърхността на средата няма да бъде гладка, за да направи флейтата правилно.
Изсипете в петриеви блюда
Веднага след хомогенизиране на кръвта се сервира в стерилни петриеви панички. Приблизително 20 ml се излива във всяка петриева паничка. Тази процедура се извършва в ламинарен поток или близо до запалката.
Когато се сервира кръвния агар в петриевите панички, не трябва да остават въздушни мехурчета на повърхността на плочата. Ако това се случи, пламъкът на горелката Bunsen бързо преминава през плочата, за да ги отстрани..
Плаките се оставят да се втвърдят и съхраняват в хладилник (2-8 ° С), обърнат докато се използва. Преди употреба кръвните агарни плаки трябва да бъдат закалени (да се вземе стайна температура), за да бъдат засяти.
Подготвените плаки продължават приблизително 1 седмица.
препратки
- Байона М. Микробиологични условия за отглеждане на Helicobacter pylori. Rev Col Gastroenterol 2013; 28 (2): 94-99
- García P, Paredes F, Fernández del Barrio M. (1994). Практическа клинична микробиология. Университет на Кадис, 2-ро издание. Служба за публикации на UCA.
- - Агарска кръв. Уикипедия, Свободната енциклопедия. 10 декември 2018, 14:55 UTC. 27 декември 2018 г., 01: 49 en.wikipedia.org.
- Forbes B, Sahm D, Weissfeld А. (2009). Микробиологична диагноза на Bailey & Scott. 12 изд. Аржентина. Panamericana S.A Редакция.
- Лаборатория за ветеринарно-диагностичен център CEDIVET. Гватемала. Достъпни на: trensa.com.
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Микробиологична диагноза. (5-то изд.). Аржентина, редакция Panamericana S.A..


