Основа, техники и приложения за оцветяване на спори
на оцветяване със спори е методологията, използвана за оцветяване на съпротивителните структури, които образуват някои бактериални родове, когато те са в неблагоприятни условия; тези структури съответстват на начин на оцеляване.
Има много родове, които образуват спори; Основните обаче са Bacillus и Clostridium. Тези родове се считат за по-подходящи, тъй като имат патогенни видове за хората.
Всеки бацил може да доведе до спори. По време на боядисване на препарата спората може да бъде намерена във вътрешността на бацила (ендоспора) или извън нея (екзоспора). С конвенционалните техники за оцветяване на бактерии - като например оцветяване по Грам - спорите остават безцветни.
Понастоящем има няколко методики за оцветяване, които могат да пресекат дебелата структура на спората, за да я боядисат. Тези методологии са много разнообразни; сред тях можем да споменем техниката на Dorner, оцветяването на Möeller и методологията на Shaeffer-Fulton, известна още като Wirtz-Conklin..
От всички споменати техники методологията на Шефер-Фултън е най-използвана в рутинните лаборатории. Името му дължи на двама микробиолози, които създадоха оцветяването през 1930 г .: Алисия Шефър и Макдоналд Фултън. Понякога обаче техниката се нарича Wirtz-Conklin в чест на двама бактериолози от 1900-те години.
индекс
- 1 Фондация
- 2 Техники на оцветяване на спори
- 2.1 Техниката на Дорнър
- 2.2 Модифицирана техника на Dorner
- 2.3 Техника на Шефър-Фултън или Виртц-Конклин
- 2.4 Möeller техника
- 2.5 Модифицирана техника на Möeller без топлина
- 3 Използване
- 3.1 Примери
- 4 Препратки
фундамент
Спорите не оцветяват с конвенционални оцветители, защото имат много дебела стена. Сложният състав на спорите предотвратява навлизането на повечето багрила.
Ако спорите се изследват отвън навътре, се наблюдават следните слоеве: първо, екзоспорият, който е най-тънкият външен слой, образуван от гликопротеини..
След това идва кутикулата, която осигурява устойчивост на високи температури, последвана от кортекс, съставен от пептидогликан. След това има стена на основата, която защитава протопласта.
Спората е дехидратирана структура, която съдържа 15% калций и дипиколинова киселина. Следователно, повечето техники за оцветяване на спори се основават на прилагането на топлина, така че багрилото да проникне в дебелата структура.
След като спората е боядисана, тя не може да елиминира боята. В техниката на Шефер-Фултон, малахитното зелено навлиза в вегетативните клетки и при прилагане на топлина прониква в ендоспората, а също и в екзоспорите.
При измиване с вода, багрилото се отстранява от вегетативната клетка. Това се случва, защото зелената малахитна боя е леко основна, така че тя се свързва слабо с вегетативната клетка.
От друга страна, тя не може да излезе от спора и накрая бацилът със сафранин е контрастен. Тази основа е валидна за останалите техники, в които се случва нещо подобно.
Техники за оцветяване на спори
За да направите спорите петна, трябва да имате чиста култура на подозрителния щам, който искате да изучавате.
Културата се подлага на екстремни температури в продължение на 24 часа, за да се стимулира микроорганизмът да спорулира. За тази цел културата може да се постави в пещ при 44 ° С или в хладилник (8 ° С) за 24 или 48 часа.
Ако остане твърде много време при споменатите температури, ще се наблюдават само екзоспори, тъй като всички ендоспори ще са напуснали бацила..
В края на времето, няколко капки стерилен физиологичен разтвор трябва да се поставят върху чист предмет. След това се взима малка част от културата и се прави фин разпръскване.
След това се оставя да изсъхне, фиксира се към топлината и се оцветява с някои от техниките, които са обяснени по-долу:
Техниката на Дорнър
1- Приготвя се в епруветка концентрирана суспензия от спороучен микроорганизъм в дестилирана вода и се добавя равен обем от филтрирания Kinyoun фенолен фуксин.
2. Поставете епруветката във вана с вряща вода за 5 до 10 минути.
3- На чиста пързалка се смесва капка от предходната суспензия с капка 10% воден разтвор на нигрозин, кипва се и се филтрира..
4- Разширете и изсушете бързо с лека топлина.
5- Изследвайте с 100X цел (потапяне).
Спорите оцветяват в червено и бактериалните клетки изглеждат почти безцветни на тъмно сив фон.
Модифицирана техника на Dorner
1- Суспензията на спорилия микроорганизъм се разстила върху предметно стъкло и се фиксира към топлината.
2- Пробата се покрива с лента от филтърна хартия, към която се добавя фуксин от фенинова киселина. Багрилото се загрява в продължение на 5 до 7 минути с пламъка на горелката Bunsen, докато се генерира отделяне на пари. След това хартията се отстранява.
3- Измийте препарата с вода и след това изсушете с абсорбираща хартия.
4- Покрийте намазката с тънък филм от 10% нигрозин, като използвате втори слайд за разпространение на нигрозин или игла.
Оцветяването, взето от спори и бактерии, е същото като онова, описано в предшестващото състояние на техниката.
Шефър-Фултън или техниката на Wirtz-Conklin
1 - Нанесете тънък спрей със суспензия на спорилия микроорганизъм върху плъзгача и го фиксирайте за загряване.
2- Покрийте плъзгача с воден разтвор от 5% малахитово зелено (върху листа може да се постави филтърна хартия).
3- Загрейте пламъка на горелката на Bunsen, за да излезе парата и да отстраните пламъка. Повторете операцията за 6 до 10 минути. Ако по време на процедурата малахитният зелен разтвор се изпари твърде много, може да се добави още.
4- Отстранете филтърната хартия (ако е поставена) и я измийте с вода.
5. Покрийте слайда с 0.5% воден разтвор на сафранин за 30 секунди (някои варианти на техниката използват 0.1% воден сафранин и го оставете за 3 минути).
При тази техника спорите са зелени и бацилите са червени.
Недостатък е, че ендоспорите на младите култури не се оцветяват добре, тъй като изглеждат изключително чисти или безцветни. За да се избегне това, се препоръчва използването на култури от 48 часа инкубация.
Möeller техника
1- Нанесете намазката с хлороформ в продължение на 2 минути.
2- Изхвърлете хлороформа.
3- Покрийте с 5% хромова киселина за 5 минути.
4- Измийте с дестилирана вода
5 - Листът се покрива с фуксин-фенолен шаран и се излага на пламъка на горелката Бунзен до изпускане на пари; след това се отстранява от пламъка за няколко минути. Операцията се повтаря, докато достигне 10 минути.
6- Измийте с вода.
7. Използвайте подкислен етанол (солна киселина) за обезцветяване. Остава за 20 или 30 секунди.
8- Измийте с дестилирана вода.
9- Противодействие на покриващия лист с метиленово синьо за 5 минути.
10- Измийте с дестилирана вода.
11- Оставя се да изсъхне и пробата се взема под микроскоп.
Спорите изглеждат червени и сини бацили. Важно е да не се вдишват парите, защото те са токсични и в дългосрочен план могат да бъдат канцерогенни.
Модифицирана техника на Möeller без топлина
През 2007 г. Hayama и неговите сътрудници създадоха модификация на техниката на Möeller. Те отстраняват нагряващия етап на багрилото и го заменят с добавянето на 2 капки повърхностноактивно вещество Tergitol 7 за всеки 10 ml фуксин-фенолен карболен разтвор. Получени са същите резултати.
приложения
Оцветяването на спорите осигурява много ценна и полезна информация за идентифициране на патогена, тъй като наличието на същото, неговата форма, местоположение в бацила и способността да се деформира вегетативната клетка или не, са данни, които могат да насочват вида участие в определен пол.
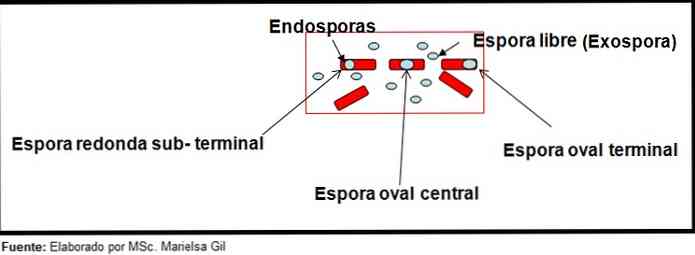
В този контекст си заслужава да се отбележи, че спорите могат да бъдат кръгли или овални, те могат да бъдат разположени в центъра или също така в парацентрална, подземна или крайна позиция..
Примери
- Clostridium difficile образува овална спора в крайно положение, която деформира бацила.
- Спората на Clostridium tertium Тя е овална, не деформира бацила и се намира на крайното ниво.
- Ендоспората на Clostridium tetani тя е терминална и деформира бацила, като придава външен вид на барабан.
- Спорите на Clostridium botulinum, C. histolyticum, C. Novy и C. septicum те са кръгли или субтерминални овални и деформират бацила.
- Ендоспората на Clostridium sordelli тя е разположена в централно положение, с лека деформация.

препратки
- Hayama M, Oana K, Козакай Т, Umeda S, Fujimoto J, Ota H, Kawakami Y. Предложение за опростена техника за оцветяване на бактериални спори без прилагане на топлинно-успешна модификация на метода на Moeller. Eur J Med Res. 16, 12 (8): 356-9.
- Уикипедия. Оцветяване на Moeller. Уикипедия, Свободната енциклопедия. 3 ноември, 2018, 03:28 UTC. Достъпни на: en.wikipedia.org
- Pérez R, Juárez M, Rodríguez (2011). Лабораторно ръководство за микробиологични техники. Катедра "Основи на микробиологията". Национален политехнически институт.
- "Endospore". Уикипедия, Свободната енциклопедия. 25 февруари 2018, 10:20 UTC. 10 Яну 2019, 02:42: en.wikipedia.org
- Силва Л., Силва С, Фернандез Н., Буено С, Тореш Дж, Рико М, Макиас Дж и сътрудници. (2006 г.). Личен състав на автономната област Екстремадура. Специфична програма Том IV. Редакционна МАД. Севиля-Испания, с. 211-212.
- Silva M, García M, Corrales J, Ponce E. (2006), специалист лабораторен техник, на галисийската здравна служба (SERGAS). Специфичен за предмета обем 2. Редакционна MAD. Севиля-Испания, стр. 79-80.
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Микробиологична диагноза. (5-то изд.). Аржентина, редакция Panamericana S.A..
- Forbes B, Sahm D, Weissfeld A. 2009. Микробиологична диагноза на Bailey & Scott. 12 изд. Аржентина. Panamericana S.A Редакция


