Фондация Ziehl-Neelsen Stain, реагенти и техника
на Ziehl-Neelsen петно в оцветяваща техника за идентифициране на алкохолно-кисели резистентни микроорганизми (ААР). Името на тази микробиологична процедура се отнася до нейните автори: бактериологът Франц Зил и патологът Фридрих Нилсен..
Тази техника е вид диференциално оцветяване, което предполага използването на различни багрила, за да се създаде контраст между структурите, които искате да наблюдавате, диференцират и по-късно идентифицират. Ziehl-Neelsen се използва за идентифициране на определени видове микроорганизми.
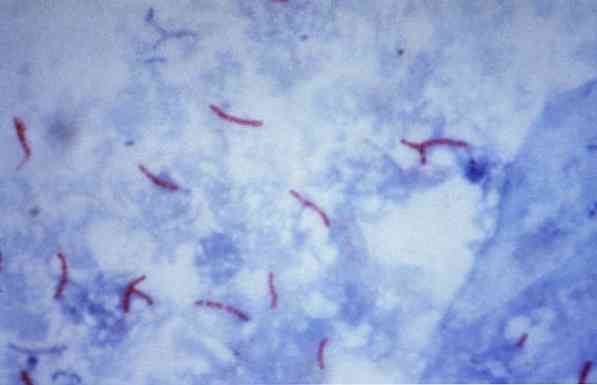
Някои от тези микроорганизми са микобактерии (например, Mycobacterium tuberculosis), нокардии (например, Nocardia sp.) и някои едноклетъчни паразити (например, Cryptosporidium parvum). Много от бактериите могат да бъдат класифицирани чрез обща техника, наречена Грам оцветяване.
Въпреки това, някои бактериални групи изискват други методи за идентифицирането им. Техники като Ziehl-Neelsen оцветяване изискват комбинации от багрила с топлина, за да фиксират първата към клетъчната стена.
След това идва процес на обезцветяване, който позволява два резултата: устойчивост или чувствителност към обезцветяване от киселини и алкохоли.
индекс
- 1 Фондация
- 1.1 Средно оцветяване
- 2 Реагента
- 2.1 Първично оцветяване
- 2.2 Обезцветяващ разтвор
- 2.3 Вторично оцветяване (анти-оцветител)
- 3 Техника
- 3.1 Процедура за оцветяване с бърза киселина
- 4 Препратки
фундамент
Основата на тази техника на оцветяване се основава на свойствата на клетъчната стена на тези микроорганизми. Стената се формира от вид мастни киселини, наречени миколови киселини; Те се характеризират с много дълги вериги.
Когато мастните киселини имат много дълги структури, те могат да запазят боите по-лесно. Някои видове бактерии е много трудно да се оцветят с Грам оцветяване, поради високото съдържание на миколова киселина в клетъчната стена..
В оцветяването на Ziehl-Neelsen се използва фенолното съединение carbol fuchsin, основно багрило. Това е способността да взаимодейства с мастните киселини на клетъчната стена, която е восъчна текстура при стайна температура.
Оцветяването с карбол фуксин се подобрява в присъствието на топлина, тъй като восъкът се топи и молекулите на багрилото се движат по-бързо в клетъчната стена.
Киселината, която се използва по-късно, служи за обезцветяване на клетките, които не са оцветени, тъй като тяхната стена не е достатъчно свързана с оцветителя; следователно, силата на киселинното обезцветяващо средство може да отстрани киселинното багрило. Клетките, които се противопоставят на това обезцветяване, се наричат устойчиви на киселини.
Вторично оцветяване
След обезцветяване на пробата, това се контрастира с друго багрило, наречено вторично багрило. Обикновено се използва метиленово синьо или малахитово зелено.
Вторичната боя оцветява основния материал и следователно създава контраст на структурите, които са боядисани в първата стъпка. Само оцветените клетки абсорбират второто багрило (анти-оцветяване) и вземат цвета си, докато киселинно-устойчивите клетки запазват червения цвят..
Тази процедура често се използва за идентифициране на Mycobacterium tuberculosis и Mycobacterium leprae, които се наричат киселинно бързи бацили.
реагенти
Първично оцветяване
Използва се карбоксин 0,3% фуксин (филтриран). Това багрило се приготвя от смес от алкохоли: фенол в етанол (90%) или метанол (95%), и в тази смес се разтварят 3 грама основен фуксин..
Обезцветяващ разтвор
В този етап могат да се използват разтвори на 3% алкохолна киселина или 25% сярна киселина.
Вторично оцветяване (анти-оцветител)
Най-често използваната боя за извършване на контраста в пробите е обикновено 0.3% метиленово синьо. Обаче, други могат също да бъдат използвани, като 0.5% малахитово зелено.
техниката
Процедура за оцветяване с бърза киселина
Пригответе бактериална намазка
Този препарат се прави на чист и сух предмет, следвайки предпазните мерки за стерилност.
Изсушаване на размазването
Оставете намазката да изсъхне при стайна температура.
Загрейте пробата
Пробата трябва да бъде загрята чрез прилагане на огън върху слайда отдолу. Фиксиране с алкохол може да се направи, когато намазката не е приготвена със слюнка (третирана с натриев хипохлорит, за да я избели) и ако няма да бъде боядисана незабавно..
M. tuberculosis Елиминира се с белина и по време на процеса на оцветяване. Термофиксирането на нелекуваната слюнка няма да убие M. tuberculosis, докато фиксирането с алкохол е бактерицидно.
Покрийте петното
Петното се покрива с карболов фуксинов разтвор (основно основно оцветяване).
Загрейте петното
Това се прави за 5 минути. Трябва да забележите отделяне на пари (приблизително 60 ° C). Важно е да не се прегрява и да не се изгаря пробата.
По отношение на загряването на петното трябва да се обърне особено внимание при нагряване на фуксин карбол, особено ако оцветяването се извършва върху тава или друг контейнер, в който от предишното петно са събрани лесно запалими химикали.
Под слайдовете трябва да се постави само малък пламък с помощта на запален тампон, предварително напоен с няколко капки киселинен алкохол, метанол или 70% етанол. Избягвайте да използвате голям тампон, напоен с етанол, защото това е опасност от пожар.
Измийте петното
Това измиване трябва да се извършва с чиста вода. Ако водата от чешмата не е чиста, измийте намазката с филтрирана или дестилирана вода, за предпочитане.
Покрийте намазката с киселинен алкохол
Този киселинен алкохол трябва да бъде 3%. Покриването се извършва за 5 минути или докато намазката е достатъчно обезцветена, т.е. бледо розова.
Трябва да се има предвид, че киселинният алкохол е запалим; затова трябва да се използва много внимателно. Избягвайте близо до източници на запалване.
Измийте петното
Измиването трябва да бъде с чиста, дестилирана вода.
Покрийте намазката с боя
Може да бъде зелен малахит (0,5%) или метиленово синьо (0,3%) багрило за 1 или 2 минути, като се използва най-дълго време, ако намазката е тънка.
Измийте петното
Чистата вода трябва да се използва отново (дестилирана).
отцеди
Гърбът на слайда трябва да се почисти и петното да се постави на дренажен рафт, така че да се изсуши на въздух (да не се използва абсорбираща хартия за сушене)..
Разгледайте намазката в микроскопа
Целта 100Х и потапящото масло трябва да се използват. Сканирайте намазката систематично и запишете съответните наблюдения.
Интерпретирайте резултатите
Теоретично, микроорганизмите, които са боядисани в червеникав цвят, се считат за киселинно-бързи (AAR +).
Обратно, ако микроорганизмите са оцветени в синьо или зелено, в зависимост от оцветителя, използван като контра-боя, те се считат за отрицателна алкохолоустойчива киселина (ААР-).
препратки
- Apurba, S. & Sandhya, B. (2016). Основи на практическата микробиология (1-ви ред.). Медицински издатели на Jaypee Brothers.
- Bauman, R. (2014). Микробиология с болести по телесна система (4-то изд.). Pearson Education, Inc..
- Heritage, J., Evans, E. & Killington, A. (1996). Въвеждаща микробиология (1-ви ред.). Cambridge University Press.
- Morello, J., Granato, P. Wilson, M. & Morton, V. (2006). Ръководство за лабораторни упражнения и учебник по микробиология: приложения към грижите за пациенти (11-то изд.). Образование McGraw-Hill.
- Vasanthakumari, R. (2007). Учебник по микробиология (1-ви ред.). B.I. Публикации PVT.


