Структура, синтез, свойства и приложения на пикриновата киселина
на пикринова киселина е високо нитрирано органично химично съединение, чието име IUPAC е 2,4,6-тринитрофенол. Неговата молекулна формула е С6Н2(NO2)3ОН. Той е много кисел фенол и може да се намери като натриев, амониев или калиев пикрат; т.е. в нейната йонна форма С6Н2(NO2)3ONa.
Това е твърдо тяло на силен вкус на горчиво, а оттам произлиза и името му от гръцката дума "прикос", което означава горчиво. Той се намира като мокри жълти кристали. Изсушаването или обезводняването му са опасни, тъй като увеличават нестабилните свойства, които го правят експлозивен.
По-горе е молекулата на пикриновата киселина. В изображението е трудно да се разпознаят връзките и атомите, защото това съответства на представянето на неговата ван дер ваалсова повърхност. Молекулярната структура е обсъдена по-подробно в следващия раздел.
Някои междинни съединения, различни пикратни соли и комплекси на пикринова киселина се синтезират от пикринова киселина..
Пикринова киселина се използва като основа за синтез на жълто-оцветени постоянни багрила. Някои патолози и изследователи го използват за фиксиране или оцветяване на тъканни участъци и други имунохистохимични процеси.
Той е много полезен при приготвянето на фармацевтични продукти. Освен това той се използва при производството на кибрит или кибрит и експлозиви. Използва се и за гравиране на метали, за оцветяване на стъкло и за колориметрично определяне на биологични параметри като креатинин.
От друга страна, пикриновата киселина дразни, когато влезе в контакт с кожата, с дихателната, очната и храносмилателната лигавица. В допълнение към нараняване на кожата, тя може да засегне сериозно бъбреците, кръвта и черния дроб, наред с другите органи.
индекс
- 1 Структура
- 1.1 Киселинен фенол
- 1.2 Кристална структура
- 2 Резюме
- 2.1 Директно нитриране на фенол
- 3 Физични и химични свойства
- 3.1 Молекулно тегло
- 3.2 Физически вид
- 3.3 Миризма
- 3.4 Вкус
- 3.5 Точка на топене
- 3.6 Точка на кипене
- 3.7 Плътност
- 3.8 Разтворимост
- 3.9 Корозивност
- 3,10 pKa
- 3.11 Нестабилност
- 4 Използване
- 4.1 Изследвания
- 4.2 Органична химия
- 4.3 В индустрията
- 4.4 Военни приложения
- 5 Токсичност
- 6 Препратки
структура

В горното изображение всички връзки и самата структура на молекулата на пикриновата киселина са показани по-подробно. Състои се от фенол с три нитро заместителя.
Може да се види, че в NO групите2 азотният атом има положителен частичен заряд и следователно изисква електронна плътност на заобикалящата го среда. Но ароматният пръстен също привлича електроните към себе си и преди трите NO2 в крайна сметка се отказва част от собствената си електронна плътност.
Като следствие от това, кислородът от ОН групата има тенденция повече да споделя един от свободните си електронни двойки, за да достави електронния дефицит, претърпян от пръстена; и по този начин се формира връзката C = O+-З. Частичното частично натоварване на кислорода отслабва О-Н връзката и повишава киселинността; тоест, той ще бъде освободен като водороден йон, Н+.
Киселинен фенол
Поради тази причина това съединение е изключително силна (и реактивна) киселина, дори повече от самата оцетна киселина. Обаче, съединението наистина е фенол, чиято киселинност надвишава тази на другите феноли; дължи, както току-що споменато, на NO заместителите2.
Следователно, тъй като е фенол, ОН групата има приоритет и насочва изброяването в структурата. Три НЕ2 те са разположени в въглероди 2, 4 и 6 на ароматния пръстен по отношение на ОН. Оттук следва номенклатурата на IUPAC за това съединение: 2,4,6-тринитрофенол (TNP, за неговото акроним на английски).
Ако групите НЕ са2, или ако има по-малък брой от тях в пръстена, О-Н връзката ще намали по-малко и следователно съединението ще има по-ниска киселинност.
Кристална структура
Молекулите на пикриновата киселина са подредени по такъв начин, че да благоприятстват техните междумолекулни взаимодействия; или за образуване на водородни мостове между ОН и NO групи2, дипол-диполни сили, или електростатични отблъсквания между дефицитни области на електрони.
Може да се очаква, че групите НЕ2 те се отблъскват и се ориентират към съседните ароматни пръстени. Освен това, пръстените не могат да бъдат подравнени един върху друг чрез увеличаване на електростатичните отблъсквания.
Продукт от всички тези взаимодействия, пикриновата киселина успява да образува триизмерна мрежа, която определя кристал; чиято единична клетка съответства на кристална система от орторомбичен тип.
синтез
Първоначално той се синтезира от природни съединения, като производни на животински рог, естествени смоли и др. От 1841 г. фенолът се използва като прекурсор на пикринова киселина, следвайки няколко пътища или чрез различни химични процедури.
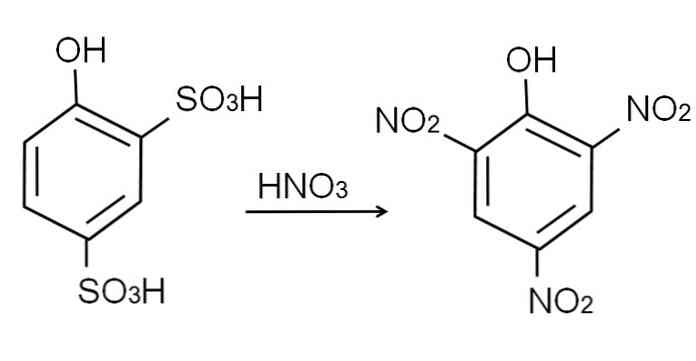
Както вече беше казано, той е един от най-киселите феноли. За да се синтезира, първо се изисква фенолът да премине през процес на сулфониране, последван от процедура на нитриране.
Сулфонирането на безводен фенол се извършва чрез третиране на фенол с димяща сярна киселина, с ароматни електрофилни замествания на Н от сулфонатни групи, SO \ t3Н, в -ортовата позиция и -за ОН групата.
Към този продукт се извършва 2,4-фенолдисулфонова киселина, процесът на нитриране се обработва с концентрирана азотна киселина. По този начин двете групи SO3Н са заместени с нитро групи, NO2, и една трета влиза в другата нитро позиция. Следното химическо уравнение илюстрира това:
Директно нитриране на фенол
Процесът на нитриране на фенола не може да се извърши директно, тъй като се генерират катрани с високо молекулно тегло. Този метод на синтез изисква много внимателен контрол на температурата, тъй като той е много екзотермичен:
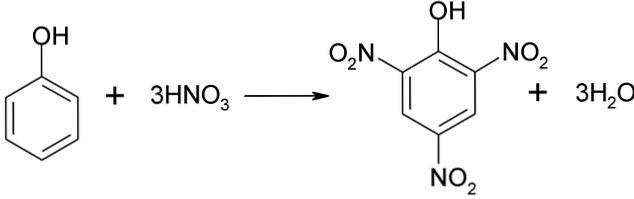
Пикринова киселина може да се получи чрез пряк процес на нитриране на 2,4-динитрофенол с азотна киселина.
Друга форма на синтез е третирането на бензол с азотна киселина и живачен нитрат.
Физични и химични свойства
Молекулно тегло
229,104 g / mol.
Физически вид
Масова или жълта суспензия на мокри кристали.
миризма
Той е без мирис.
вкус
Тя е много горчива.
Точка на топене
122,5 ° С.
Точка на кипене
300 ° С. Но когато се стопи, той експлодира.
плътност
1.77 g / mL.
разтворимост
Той е умерено разтворим във вода. Това е така, защото техните ОН и NO групи2 те могат да взаимодействат с водни молекули чрез водородни връзки; въпреки че ароматният пръстен е хидрофобен и следователно неговата разтворимост е нарушена.
корозивно
Пикринова киселина е корозивна като цяло за метали, с изключение на калай и алуминий.
рКа
0.38. Той е силна органична киселина.
нестабилност
Пикринова киселина се характеризира със своите нестабилни свойства. Той представлява риск за околната среда, той е нестабилен, експлозивен и токсичен.
Трябва да се съхранява плътно затворена, за да се избегне дехидратация, тъй като пикриновата киселина е много експлозивна, ако се остави да изсъхне. Човек трябва да бъде много внимателен с безводната си форма, защото е много чувствителен към триене, шок и топлина.
Пикринова киселина трябва да се съхранява на проветриви, хладни места, далеч от окисляеми материали. Той е дразнещ за кожата и лигавиците, не трябва да се поглъща и е токсичен за организма.
приложения
Пикринова киселина е широко използвана в научните изследвания, химията, промишлеността и военните.
изследване
Когато се използва като фиксатор на клетки и тъкани, той подобрява резултатите от оцветяването им с кисели багрила. Това се случва с трихромни методи за оцветяване. След фиксиране на тъканта с формалин се препоръчва нова фиксация с пикринова киселина.
По този начин се гарантира интензивно и много ярко оцветяване на тъканите. Добри резултати не се получават с основни багрила. Трябва обаче да се вземат предпазни мерки, тъй като пикриновата киселина може да хидролизира ДНК, ако остане твърде много време.
Органична химия
-В органичната химия се използва като алкални пикрати за извършване на идентификация и анализ на различни вещества.
-Използва се в аналитичната химия на металите.
-В клиничните лаборатории се използва за определяне на нивата на креатинин в серума и урината.
-Той е използван и в някои от реактивите, които се използват за анализ на нивата на глюкоза.
В индустрията
-На нивото на фотографската индустрия пикриновата киселина се използва като сенсибилизатор в фотографските емулсии. Тя е част от разработването на продукти като пестициди, силни инсектициди и др.
-Пикринова киселина се използва за синтезиране на други междинни химични съединения, като например хлоропикрин и пикраминова киселина. Някои лекарства и багрила за кожарската индустрия са разработени от тези съединения.
-Пикринова киселина се използва за лечение на изгаряния, като антисептични и други състояния, преди да се докаже токсичността му.
-Важен компонент поради експлозивния си характер при производството на кибрит и батерии.
Военни приложения
-Поради високата експлозивност на пикриновата киселина, тя е била използвана във военни боеприпаси за оръжия.
-Пресованата и разтопена пикринова киселина се използва в артилерийски снаряди, гранати, бомби и мини.
-Амониевата сол на пикриновата киселина е използвана като експлозив, тя е много мощна, но по-малко стабилна от TNT. За известно време се използва като компонент на горивото на ракетите.
токсичност
Доказано е, че е много токсичен за човешкото тяло и като цяло за всички живи същества.
Препоръчва се да се избягва неговото вдишване и поглъщане поради острата му орална токсичност. Той също причинява мутации в микроорганизмите. Представя токсични ефекти върху дивата природа, бозайниците и като цяло в околната среда.
препратки
- Греъм Соломонс T.W., Крейг Б. Фрайле. (2011 г.). Органична химия. Амини. (10тата издание.). Wiley Plus.
- Кери Ф. (2008). Органична химия (Шесто издание). Mc Graw Hill.
- Wikipedia. (2018). Пикринова киселина. Изтеглено от: en.wikipedia.org
- Университет Пърдю. (2004 г.). Взрив на пикринова киселина. Изтеглено от: chemed.chem.purdue.edu
- Проект за кристалография 365. (10 февруари 2014 г.). По-малко от мек жълт - структурата на пикринова киселина. Взето от: crystallography365.wordpress.com
- PubChem. (2019). Пикринова киселина Възстановен от: pubchem.ncbi.nlm.nih.gov
- Baker, J.R. (1958). Пикринова киселина Methuen, Лондон, Великобритания.


