Химическа структура, свойства и употреба на манганов оксид (MnO2)
на манганов оксид (манганов2) е неорганично химично съединение, образувано от елемента манган с окислително число + 4 и кислород, който при образуването на оксиди има окислително число -2. Той е известен и с наименованията на манганов (IV) оксид и манганов анхидрид.
Това е твърдо от тъмно до черно кафе. Той е в природата като минерал пиролусит, черен и кристализиращ, образуващ дендрити (разклонени удължения). Може да се получи като черен остатък в реакцията между етилен и калиев перманганат след образуването на гликол чрез окислително действие на калиев перманганат..

Той е много важен в стъкларската промишленост поради неговия характер на окислител, тъй като елиминира зеления цвят, идващ от железните съединения и ги превръща в железен.
индекс
- 1 Химическа структура
- 2 Свойства
- 3 Използване
- 3.1 Като катализатор
- 4 Ефекти върху здравето
- 5 Препратки
Химическа структура
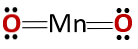
Химическата структура на съединението съответства на тази на анхидрид, а не на основния оксид, както се очаква, тъй като се състои от метал и неметален материал..
Този специален случай се дължи на поведението, което манганът приема в различните състояния на окисление. Така за окислителните състояния +2 и +3 се образуват оксидите MnO и Mn2О3 съответно, че при взаимодействие с вода те образуват съответно манганов хидроксид и манганов хидроксид.
Въпреки това, Mn2О3 в слабо кисела среда той се държи като анхидрид. С окислителните състояния +4, +6 и +7, MnO2, MnO3 и MnO4 образуват киселини, когато реагират с вода.
В слабо кисела среда MnO2 той се държи като основен оксид, така че може да образува съответния хидроксид.

Трябва да се има предвид, че в този случай не се споменават амфотерни свойства, според които съединението може да се държи като киселина или като основа. Това е специален случай на поведение на Mn.
свойства
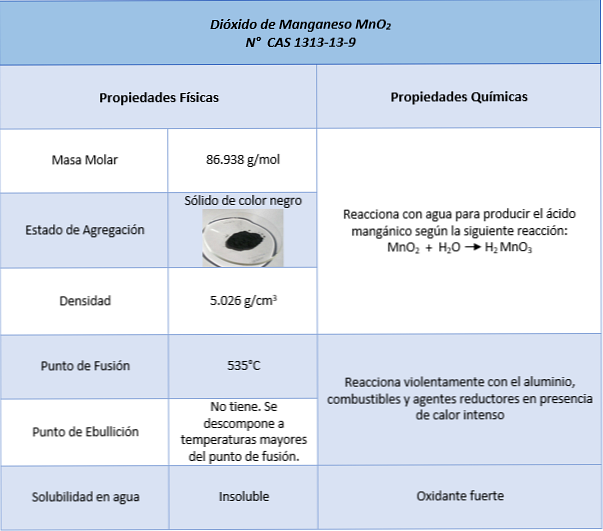
приложения
- Използва се като източник на манган
- Като окислител в алкални батерии
- Бои за стъкло, керамика и порцелан.
- При получаване на хлор и йод.
- В разлагането на водороден пероксид за образуване на газообразен кислород и вода.
- В реакция на разлагане на калиев хлорат за производството на газообразен кислород и калиев хлорид.
- Разтворен в ацетон или в дихлорометан, окислява първичните алкохоли до алдехиди и вторични до кетони.
- Производство на алкални батерии.
Като катализатор
Това се отнася за окисно-редукционни реакции, за отстраняване на сулфиди като Н2S и катиони като Fe+2 и Mn+2 , арсен и радио, открити в подпочвените води, които са замърсени от този тип съединения.
Това замърсяване може да се генерира или от неконтролирано изхвърляне на токсични материали, от измиване на замърсена почва или от наличието на химически елементи по време на извличането на вода..
МпО2 Високата чистота, получена от пиролузита, използван като филтър (Filox), е най-ефективното средство за отстраняване на този клас примеси от подпочвените води.
Ефекти върху здравето
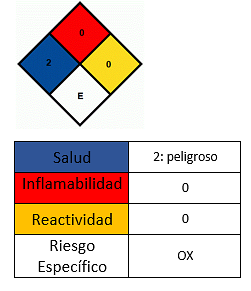
- Избягвайте контакт с кожата.
- В случай на контакт, измийте съответната област.
- Не вдишвайте праховете.
- Дразнене и зачервяване могат да се видят при контакт с очите. Измийте обилно с вода, оставете водата да тече през очите и да се обадите за медицинска помощ в случай на сериозно заболяване.
- При контакт с кожата се наблюдава дразнене и зачервяване. Измийте засегнатата област с много вода и сапун.
- Продължителният контакт с кожата премахва естествените ви мазнини, предизвиквайки дерматит.
- Вдишването може да предизвика грипоподобно състояние (метални изпарения). Състоянието се характеризира с висока температура, студени тръпки, сухота в устата и гърлото, мускулни болки и главоболие.
- Той може да раздразни дихателните пътища и да увеличи честотата на респираторни инфекции (пневмония). Интоксикацията чрез абсорбция на неорганични манганови соли през белите дробове е малко вероятно, но може да настъпи хронично отравяне..
- Хроничното излагане на прах или дим от манганов диоксид за дълъг период може да засегне централната нервна система и да доведе до развитие на болестта на Паркинсон, трудности при ходене, мускулни спазми и промени в поведението.
- Поглъщането може да причини болки в корема и гадене.
- Той не е запалим, но помага за разпространението на огъня в материалите с нажежаема жичка. Ако се загрее до температура над 535 ° C, веществото се разлага до манганов оксид (III) Mn2О3 и кислород, който е запалим и увеличава опасността от пожар. В този случай пожарът трябва да бъде потушен с пяна или въглероден диоксид.
- В случай на разливане, не манипулирайте съединението без подходяща лична защита.
- Съхранявайте съединението в плътно затворени контейнери, на студено и сухо място, далеч от несъвместими вещества като органични материали и горими материали.
- Мястото за съхранение трябва да бъде сухо и с подове, устойчиви на киселинна корозия и с добър дренаж..
- Трябва да се използват лични предпазни средства, като ръкавици, предпазни очила, противопарови филтърни маски, прах и дим.
препратки
- B, (2015), Манганов диоксид, Кралското общество по химия - света на химията, извлечен от chemistryworld.com
- Karal, (2014), Mangneso Dioxide, Информационен лист за безопасност, възстановен от, karal.com.mx
- Вашият виртуален учител (02.25.2015). Манганови неорганични съединения (специален случай 1) - Теоретичен урок), извлечен от youtube.com
- Ecured, (s.f), манганов диоксид, възстановен от ecured.cu
- Angarita G, Johnny., (2017), манганов диоксид: изключителна технология. Hidroteco, възстановен от hydrotecocr.com
- Fernández, G., (2015), MnO манганов диоксид2/ ацетон, Органична химия, Възстановен от quimicaorganica.net
- Tronox, (2011), манганов диоксид, информационен лист за безопасност, възстановен от, tronox.com


